Radon
| Radon | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Periodiske system | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generelt | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtegn | Rn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomnummer | 86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration |
2, 8, 18, 32, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe | 18 (Ædelgas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomare egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 222 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 145 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | Xe; 4f14 5d10 6s² 6p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroner i hver skal | 2, 8, 18, 32, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstrin | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysiske egenskaber | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tilstandsform | gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalstruktur | Kubisk, F-centreret | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefylde (gas) | 5,894 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | −71,2 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kogepunkt | −61,9 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritisk punkt | 377,0, 6,28 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltevarme | 3,25 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 18,10 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmefylde | 20,786 J·mol–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varmeledningsevne | 3,61 W·m–1K–1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetiske egenskaber | Ikke magnetisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Radon er et grundstof med atomnummer 86 og symbol Rn i det periodiske system. Radon, der dannes fra radiums henfald, er en farveløs naturligt forekommende ædelgas. Den er en af de tungeste stoffer, der under normale forhold er gasforming og den anses for at være en sundhedsrisiko. Alle radons isotoper er radioaktive. Den mest stabile isotop, 222Rn, har en halveringstid på 3,8 dage og anvendes til strålebehandling.
Selvom radon, på grund af sin radioaktivitet, er undersøgt i mindre grad af kemikere, kendes nogle få kemiske stoffer hvori radon indgår.
Radon kan sive fra undergrunden og forurene luftkvaliteten indendørs verden over. I Danmark vurderes at omkring 4,6% af enfamiliehuse har et indendørs radonniveau over den nedre grænseværdi på 200 Bq/m3 [1].
Historie og etymologi
Radon var, efter radium og polonium, det tredje radioaktive grundstof der blev opdaget. Det blev opdaget i 1898 af Friedrich Ernst Dorn.[2][3][4] I 1900 beskrev han nogle eksperimenter hvor han observerede at radium udstrålede en radioaktiv gas, som han kaldte Radium Emanation (Ra Em).[5] Tidligere, i 1899, observerede Pierre og Marie Curie at den "gas" som blev emitteret fra radium forblev radioaktiv i en måned. [6] Senere samme år bemærkede Robert B. Owens og Ernest Rutherford variationer når de forsøgte at måle strålingen fra thoriumoxid.[7] Rutherford bemærkede at thoriumforbindelserne konstant udsendte en radioaktiv gas, som vedblev at være radioaktiv i flere minutter, han kaldte denne gas "emanation" (udstråling),[8] og senere Thorium Emanation (Th Em). I 1901 demonstrerede han at udstrålingen var radioaktiv, men gav Curie'erne æren for opdagelsen af grundstoffet.[9] I 1903 blev lignende udstrålinger observeret fra actinium af André-Louis Debierne[10][11] og blev kaldt Actinium Emanation (Ac Em).
Der blev foreslået flere navne for disse tre gasser: exradio, exthorio, og exactinio i 1904;[12] radon, thoron, og akton i 1918;[13] radeon, thoreon, og actineon i 1919,[14] og radon, thoron og actinon i 1920.[15] Pga. lighederne mellem spektre af disse tre gasser, og spektre af argon, krypton og xenon foreslog Sir William Ramsay i 1904 at "udstrålingerne" indeholdt et nyt grundstof af ædelgasfamilien.[12]
I 1910 isolerede Sir William Ramsay og Robert Whytlaw-Gray radon, bestemte dets massefylde og fandt at det var den tungeste kendte gas.[16] De foreslog det nye navn niton (Nt) (fra latin nitens, som betyder skinnende) for at understrege den af gassers egenskaber der er ansvarlig for nogler substancers fosforescens, [16] og i 1912 blev navnet accepteret af the International Commission for Atomic Weights. I 1923 valgte International Committee for Chemical Elements og International Union of Pure and Applied Chemistry (IUPAC) navnene radon (Rn), thoron (Tn), og actinon (An). Senere, da isotoper ikke længere blev navngivet, men i stedet nummereret, fik grundstoffet navn efter den mest stabile isotop, radon, og Tn blev til 220Rn og An til 219Rn. Så sent som i 1960'erne blev grundstoffet stadig omtalt som "udstrålingen".[17] Den første syntetiske radonforbindelse, radonfluorid, blev fremstillet i 1962.[18]
Kemi
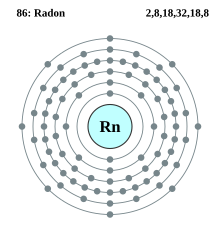
Radon er en ædelgas eller inert gas. Den er inert overfor de fleste kemiske reaktioner fordi den har otte elektroner i den yderste skal. Dette resulterer i en stabil lavenergikonfiguration, hvor de yderste elektroner sidder godt fast.[19] Radon har dog en lavere elektronegativitet end grundstoffet i perioden før, Xenon, og er derfor mere reaktiv.
Pga. radioaktiviteten, og fordi det er meget dyrt, udføres der sjældent eksperimentel kemisk forskning med Radon, og der er også kun rapporteret om ganske få radonforbindelser, som alle er fluorider eller oxider. Radon kan oxideres af nogle få kraftige oxidationsmidler som f.eks. F2 og danne radonfluorid.[20][21] Radonoxider er blandt de få andre kendte radonforbindelser.[22]
Isotoper
Radon har ingen stabile isotoper. Der er blevet studeret 34 radioaktive isotoper der varierer i masse fra 195 til 228 atomare enheder.[23] Den mest stabile isotop er 222Rn, der er henfaldsproduktet fra 226Ra. Den har en halveringstid på 3,823 dage og henfalder ved udsendelse af en alfapartikel til 218Po.[24] Denne henfaldskæde omfatter også den meget ustabile isotop 218Rn. Den naturligt forekommende 226Ra er et produkt af 238U's henfaldskæde.[25] Denne henfaldsserie (med halveringstider) er:
- 238U (4,5 x 109 år) → 234Th (24,1 dage) → 234Pa (1,18 min) → 234U (250.000 år) → 230Th (75.000 år) → 226Ra (1.600 år) → 222Rn (3,82 dage) → 218Po (3,1 min) → 214Pb (26,8 min) → 214Bi (19,7 min) → 214Po (164 µs) → 210Pb (22,3 år) → 210Bi (5,01 dage) → 210Po (138 dage) → 206Pb (stabil)
Der findes tre andre isotoper som har halveringstid længere end en time: 211Rn, 210Rn og 224Rn. 220Rn-isotopen er et naturligt henfaldsprodukt af den mest stabile thoriumisotop (232Th), som kaldes thoron. Den har en halveringstid på 55,6 sekunder og udsender alfa-stråling. 219Rn er et tilsvarende produkt fra henfald af den mest stabile actiniumisotop (227Ac), som kaldes actinon. Den udsender også alfa-stråling og har en halveringstid på 3,98 sekunder.[23]
Ekstern link
Kilder
- ^ "Radon i boliger". Sundhedsstyrelsen. 12/10 2007. Hentet 3/4 2008.
{{cite web}}: Tjek datoværdier i:|accessdate=og|date=(hjælp) - ^ Bentor, Yinon (2006). "Periodic Table: Date of Discovery". Hentet 2008-02-28.
- ^ Partington, J. R. (maj 1957). "Discovery of Radon". Nature. 179 (4566): 912.
{{cite journal}}: CS1-vedligeholdelse: Dato automatisk oversat (link) - ^ "Timeline of Element Discovery". The New York Times Company. 2008. Hentet 2008-02-28.
- ^ Dorn, Friedrich Ernst (1900). "Ueber die von radioaktiven Substanzen ausgesandte Emanation". Abhandlungen der Naturforschenden Gesellschaft zu Halle. Stuttgart. 22: 155.
- ^ Curie, P.; Curie, Mme. Marie (1899). "Sur la radioactivite provoquee par les rayons de Becquerel". Comptes rendus hebdomadaires des seances de l'Academie des sciences. 129: 714-716.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ E, Rutheford; Owens, R. B. (1899). "Thorium and uranium radiation". Trans. R. Soc. Can. 2: 9-12.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link): "the radiation from thorium oxide was not constant, but varied in a most capricious manner." whereas "all the compounds of Uranium give out a radiation which is remarkably constant" - ^ Rutheford, E. (1900). "A radioactive substance emitted from thorium compounds". Philosophical Magazine. 40: 1-4.
- ^ Rutheford, E.; Brooks, H.T. (1901). "The new gas from radium". Trans. R. Soc. Can. 7: 21-25.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Giesel, Fritz (1903). "Ueber den Emanationskörper aus Pechblende und über Radium". Chemische Berichte. 36 (1): 342-347. doi:10.1002/cber.19030360177.
- ^ Debierne, André-Louis (1903). "Sur la radioactivite induite provoquee par les sels d'actinium". Comptes rendus hebdomadaires des seances de l'Academie des sciences. 136: 446.
- ^ a b Ramsay, Sir William; Collie, J. Normal (1904). "The Spectrum of the Radium Emanation". Proceedings of the Royal Society of London. 73: 470-476. doi:10.1098/rspl.1904.0064.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Schmidt, Curt (1918). "Periodisches System und Genesis der Elemente". Z. anorg. Ch. 103: 79-118. doi:10.1002/zaac.19181030106.
- ^ "Radon". Ann. Physique. 11: 5. 1919.
- ^ Adams, Elliot Quincy (1920). "The Independent Origin of Actinium". Journal of the American Chemical Society. 42: 2205-2208. doi:10.1021/ja01456a010.
- ^ a b Ramsay, W.; Gray, R. W. (1910). "La densité de l'emanation du radium". Comptes rendus hebdomadaires des seances de l'Academie des sciences. 151: 126-128.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Grosse, A. V. (1965). "Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)". Journal of Inorganic and Nuclear Chemistry. Elsevier Science Ltd. 27 (3): 509-519. doi:10.1016/0022-1902(65)80255-X.
- ^ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). "Radon Fluoride". Journal of the American Chemical Society. 84 (21): 4164-4165. doi:10.1021/ja00880a048.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Bader, Richard F.W. "An Introduction to the Electronic Structure of Atoms and Molecules". McMaster University. Hentet 2008-06-26.
- ^ Stein, L. (1970). "Ionic Radon Solution". Science. 168: 362. doi:10.1126/science.168.3929.362. PMID 17809133.
- ^ Pitzer, Kenneth S. (1975). "Fluorides of radon and element 118". J. Chem. Soc., Chem. Commun.: 760-761. doi:10.1039/C3975000760b.
- ^ Avrorin, V. V.; Krasikova, R. N.; Nefedov, V. D.; Toropova, M. A. (1982). "The Chemistry of Radon". Russ. Chem. Review. 51 (1): 12-20. doi:10.1070/RC1982v051n01ABEH002787.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ a b Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Hentet 2008-06-06.
- ^ Sonzogni, Alejandro. "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Hentet 2008-06-06.
- ^ Principal Decay Scheme of the Uranium Series
 |
Wikimedia Commons har medier relateret til: |
