Atom: Forskelle mellem versioner
Zelrin (diskussion | bidrag) m Gendannelse til seneste version ved Dannebrog Spy, fjerner ændringer fra 212.112.133.38 (diskussion | bidrag) Tag: Tilbagerulning |
grammatisk fejl på 2. linje |
||
| Linje 8: | Linje 8: | ||
Ordet atom stammer fra det [[oldgræsk]]e ord ἄτομος (''átomos''), der betyder udelelig: Grækerne forestillede sig [[Demokrit#Atomteorien|atomet som en absolut "mindste" enhed, som materien kan opdeles i]]. |
Ordet atom stammer fra det [[oldgræsk]]e ord ἄτομος (''átomos''), der betyder udelelig: Grækerne forestillede sig [[Demokrit#Atomteorien|atomet som en absolut "mindste" enhed, som materien kan opdeles i]]. |
||
Atomer består af en [[elektrisk ladning|positiv ladet]] [[atomkerne|kerne]] og bundne negativt ladede [[elektron]]er. Kernen er kun ca. en hundredetusindedel af atomets samlede størrelse, men rummer næsten al [[Masse (fysik)|massen]]. Kernen består [[nukleon]]er, der er positivt ladede [[proton]]er og neutrale [[neutron]]er. Antallet af protoner - [[atomnummer]]et - bestemmer [[grundstof]]fet, mens antallet af neutroner bestemmer, hvilken [[isotop]] atomet er. Hvis f.eks. et [[svovl]]atom (atomnummer 16) spaltes i to lige stor dele, vil de således være [[ilt]]atomer (atomnummer 8) og ikke længere svovl. |
Atomer består af en [[elektrisk ladning|positiv ladet]] [[atomkerne|kerne]] og bundne negativt ladede [[elektron]]er. Kernen er kun ca. en hundredetusindedel af atomets samlede størrelse, men rummer næsten al [[Masse (fysik)|massen]]. Kernen består af [[nukleon]]er, der er positivt ladede [[proton]]er og neutrale [[neutron]]er. Antallet af protoner - [[atomnummer]]et - bestemmer [[grundstof]]fet, mens antallet af neutroner bestemmer, hvilken [[isotop]] atomet er. Hvis f.eks. et [[svovl]]atom (atomnummer 16) spaltes i to lige stor dele, vil de således være [[ilt]]atomer (atomnummer 8) og ikke længere svovl. |
||
Hvis antallet af protoner og elektroner er lige, er atomet elektrisk neutralt. Men hvis et atom har flere eller færre elektroner end protoner, har atomet en effektiv ladning og kaldes for en [[ion]]. |
Hvis antallet af protoner og elektroner er lige, er atomet elektrisk neutralt. Men hvis et atom har flere eller færre elektroner end protoner, har atomet en effektiv ladning og kaldes for en [[ion]]. |
||
Versionen fra 2. apr. 2020, 11:05
 Denne artikel omhandler en kemisk bestanddel. Opslagsordet har også en anden betydning, se Atom (programmering).
Denne artikel omhandler en kemisk bestanddel. Opslagsordet har også en anden betydning, se Atom (programmering).
Der er ingen kildehenvisninger i denne artikel, hvilket er et problem. (oktober 2016) (Lær hvordan og hvornår man kan fjerne denne skabelonbesked) |
Denne artikel behøver tilretning af sproget. Sproget i denne artikel er af lav kvalitet på grund af stavefejl, grammatikfejl, uklare formuleringer eller sin uencyklopædiske stil. (juni 2019) (Lær hvordan og hvornår man kan fjerne denne skabelonbesked) |

Et atom er som den mindste kendte kemiske bestanddel, som et materiale kan opdeles i.
Ordet atom stammer fra det oldgræske ord ἄτομος (átomos), der betyder udelelig: Grækerne forestillede sig atomet som en absolut "mindste" enhed, som materien kan opdeles i.
Atomer består af en positiv ladet kerne og bundne negativt ladede elektroner. Kernen er kun ca. en hundredetusindedel af atomets samlede størrelse, men rummer næsten al massen. Kernen består af nukleoner, der er positivt ladede protoner og neutrale neutroner. Antallet af protoner - atomnummeret - bestemmer grundstoffet, mens antallet af neutroner bestemmer, hvilken isotop atomet er. Hvis f.eks. et svovlatom (atomnummer 16) spaltes i to lige stor dele, vil de således være iltatomer (atomnummer 8) og ikke længere svovl.
Hvis antallet af protoner og elektroner er lige, er atomet elektrisk neutralt. Men hvis et atom har flere eller færre elektroner end protoner, har atomet en effektiv ladning og kaldes for en ion.
En kemisk sammensætning af atomer kaldes en kemisk forbindelse. Eksempler på kemiske forbindelser er molekyler og salte.
Atomkernen holdes sammen af den stærke kernekraft, så protonerne ikke frastøder hinanden.
Notation
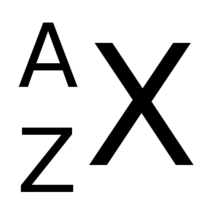
Atomkernen i et grundstof med nukleoner og protoner skrives som . Fx skrives carbon-14 som eller ofte blot .
Neutrontallet er ikke nødvendigt at have med i denne notation, men er relateret til de andre tal ved:
Historie
Filosoffen Demokrit (460-370 f.Kr.) menes at være den første, som i år 440 f.Kr. fremsatte sin hypotese om, at verden består af en masse små dele.[1] Dem kaldte han atomos. Han postulerede, at atomerne udførte mekaniske bevægelser, at de hang sammen vha. kroge, og at de havde forskellige størrelser og omkredse.
Denne teori mødte stor modstand. Folk kunne ikke acceptere, at alt bestod af atomer, også immaterielle begreber, som f.eks. sjæl og mod, og de kunne ikke acceptere den determinisme, som lå i modellen.
Omkring samme tid kom Aristoteles med sin berømte teori om, at verden bestod af de fire elementer jord, vand, luft og ild. Denne teori var meget nemmere at forstå og var mere forenelig med datidens religion, hvilket kan være grunden til, at dette blev den dominerende teori.
Sådan stod det på i mange hundrede år. Aristoteles' teori blev efterhånden integreret i religionen, og man blev betragtet som kætter, hvis man ikke troede på Aristoteles. Demokrits teori gik i glemmebogen.
Man skal helt frem til 1500-tallet for at finde eksempler på folk, som trodsede Aristoteles og kirken. Peter Ramus forkastede Aristoteles' teorier ved at påvise, at vindampe kunne trænge igennem 4 lag papir. Dette indikerede, at der muligvis kunne være noget om Demokrits teori.
I 1600-tallet blev atomteorien fremstillet på sådan en måde, at den var mere forenelig med religionen. Pierre Gassendi sagde, at atomerne var skabt af Gud, så man var ikke nødvendigvis kætter ved at tro på Demokrits atomteori.
I 1803 gjorde John Dalton en opsigtsvækkende opdagelse. Han havde studeret atomteorien, og det lykkedes ham vha. forskellige eksperimenter at finde et system i atomerne. Han regnede ud, hvor mange slags af hvilke atomer, der skulle til for at danne bestemte molekyler.
I 1913 opstillede Niels Bohr en model for brintatomet, som er det simpleste af alle atomer. Bohrs atommodel repræsenterer et mellemstadium mellem en klassisk elektrodynamisk og en moderne kvantemekanisk beskrivelse af brintatomet. Bohrs atommodel angiver korrekt bølgelængderne af lyset i brintatomets linjespektrum.
Atommodeller
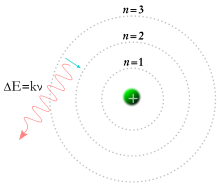
En atommodel er en model til beskrivelse af atomets opbygning.
Se også
- Fysik
- Partikelfysik
- Subatomar partikel
- Proton
- Neutron
- Elektron
- Foton
- brintatomet
- Atommodel (Bohr)
- Atommodel (bølge)
Noter








