Kjeldahl-metoden: Forskelle mellem versioner
PerV (diskussion | bidrag) m småret |
m →Intro: lidt for knudret |
||
| Linje 7: | Linje 7: | ||
[[Kviksølv]], [[kobber]] og [[selen]]forbindelser [[katalyse]]rer katalyse<nowiki/>processen. For at fremskynde reaktionen hæves kogepunktet for koncentreret svovlsyre (338 °C for 98% svovlsyre) ved tilsætning af {{chem|K|2|SO|4}}. Fordøjelsen udføres i en langhalset [[Kjeldahl-kolbe]] der forhindrer tab af prøven fra sprøjt. Alternative fordøjelseprocedurer anvender desuden {{chem|link=svovlsyre|H|2|SO|4}} plus {{chem|link=Brintoverilte|H|2|O|2}} eller {{chem|link=Kaliumperoxodisulfat|K|2|S|2|O|8}}. |
[[Kviksølv]], [[kobber]] og [[selen]]forbindelser [[katalyse]]rer katalyse<nowiki/>processen. For at fremskynde reaktionen hæves kogepunktet for koncentreret svovlsyre (338 °C for 98% svovlsyre) ved tilsætning af {{chem|K|2|SO|4}}. Fordøjelsen udføres i en langhalset [[Kjeldahl-kolbe]] der forhindrer tab af prøven fra sprøjt. Alternative fordøjelseprocedurer anvender desuden {{chem|link=svovlsyre|H|2|SO|4}} plus {{chem|link=Brintoverilte|H|2|O|2}} eller {{chem|link=Kaliumperoxodisulfat|K|2|S|2|O|8}}. |
||
Efter fordøjelsen er færdig, tilsættes [[Natriumhydroxid|NaOH]] |
Efter fordøjelsen er færdig, tilsættes [[Natriumhydroxid|NaOH]], som er [[Base (kemi)|basisk]], til opløsningen hvorved {{chem|link=Ammoniumion|NH|4}} omdannes til {{chem|link=Ammoniak|NH|3}}. Herefter destilleres opløsningen over i en beholder med en kendt mængde [[HCl]]. HCl og NH<sub>3</sub> reagerer i [[Mol (enhed)|molforholdet]] 1:1 i reaktionen. Overskydende, uomsat HCI [[Titrering|titreres]] efterfølgende med [[NaOH]]. Forskellen mellem den kendte mængde af HCl og den brugte mængde af NaOH svarer til mængden af [[Nitrogen|N]] i prøven.<ref name=":0" /> |
||
== Referencer == |
== Referencer == |
||
Versionen fra 6. aug. 2020, 18:38

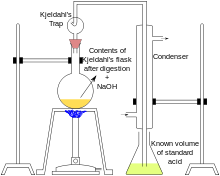
Udviklet i 1883 af danskeren Johan Kjeldahl, kvælstofanalysen Kjeldahl-metoden er en af de mest udbredte metoder til bestemmelse af kvælstof i organiske stoffer. Protein er den væsenligste nitrogenholdige bestanddel af fødevarer. De fleste proteiner indeholder tæt på 16 %vol nitrogen, så at måle nitrogen er en indirekte måling af protein.
I Kjeldahl-metoden bliver en prøve først "fordøjet" (nedbrudt og opløst) i kogende svovlsyre, der omdanner organiske aminoforbindelser til ammonium, NH+4, og oxiderer andre elementer der er til stede i prøven. Således omdannes C, H og N til CO2, H2O og NH+4.[1]
Kviksølv, kobber og selenforbindelser katalyserer katalyseprocessen. For at fremskynde reaktionen hæves kogepunktet for koncentreret svovlsyre (338 °C for 98% svovlsyre) ved tilsætning af K2SO4. Fordøjelsen udføres i en langhalset Kjeldahl-kolbe der forhindrer tab af prøven fra sprøjt. Alternative fordøjelseprocedurer anvender desuden H2SO4 plus H2O2 eller K2S2O8.
Efter fordøjelsen er færdig, tilsættes NaOH, som er basisk, til opløsningen hvorved NH4 omdannes til NH3. Herefter destilleres opløsningen over i en beholder med en kendt mængde HCl. HCl og NH3 reagerer i molforholdet 1:1 i reaktionen. Overskydende, uomsat HCI titreres efterfølgende med NaOH. Forskellen mellem den kendte mængde af HCl og den brugte mængde af NaOH svarer til mængden af N i prøven.[1]
Referencer
- ^ a b Quantitative Chemical Analasys, 8 Edition, Daniel C. Harris; ISBN 978-1-4292-1815-3
