Blåsyre: Forskelle mellem versioner
| Linje 68: | Linje 68: | ||
=== Anvendelse i kemisk krigsførelse === |
=== Anvendelse i kemisk krigsførelse === |
||
En blåsyrekoncentration på få hundrede [[Parts per million|ppm]] i luft vil slå et menneske ihjel i løbet af få minutter<ref>{{cite book | last = Chang|first=Raymond|title=Chemistry|publisher=McGraw-Hill|date=2004|edition=8th|pages=879|isbn=0-07-111318-5}}</ref>. Giftigheden skyldes cyanidionen, der forhindrer den [[Celle (biologi)|cellulære]] [[respiration]]. Mest kendt som middel i kemisk krigsførelse er blåsyre nok under navnet [[Zyklon B]], der blev brugt af [[Adolf Hitler|Hitlers]] nazi-regime til udryddelsen af jøder og andre politiske modstandere under [[2. verdenskrig]]. |
En blåsyrekoncentration på få hundrede [[Parts per million|ppm]] i luft vil slå et menneske ihjel i løbet af få minutter<ref>{{cite book | last = Chang|first=Raymond|title=Chemistry|publisher=McGraw-Hill|date=2004|edition=8th|pages=879|isbn=0-07-111318-5}}</ref>. Giftigheden skyldes cyanidionen, der forhindrer den [[Celle (biologi)|cellulære]] [[respiration]]. Mest kendt som middel i kemisk krigsførelse er blåsyre nok under navnet [[Zyklon B]], der blev brugt af [[Adolf Hitler|Hitlers]] nazi-regime til udryddelsen af jøder og andre politiske modstandere under [[2. verdenskrig]]. |
||
== Se også == |
== Se også == |
||
Versionen fra 27. jan. 2016, 14:34
| Blåsyre | ||||
|---|---|---|---|---|
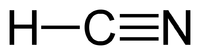
| ||||
| Generelt | ||||
| Systematisk navn | Hydrogencyanid | |||
| Andre navne | Blåsyre, cyanbrinte, hydrogencyanid | |||
| Molekylformel | HCN | |||
| Molmasse | 27.03 g/mol | |||
| Fremtræden | Farveløs eller blegblå gas | |||
| CAS nummer | [74-90-8] | |||
| PubChem | ||||
| SMILES | C#N | |||
| Egenskaber | ||||
| Massefylde | 0.687 g/cm3 | |||
| Opløselighed i vand | Fuldstændig opløselig | |||
| Smeltepunkt | -13.4 °C | |||
| Kogepunkt | 25.7 °C | |||
| Syrestyrkekonstant (pKa) | 9.21 | |||
| Viskositet | 0.201 cP | |||
| Struktur | ||||
| Dipolmoment | 2.98 D | |||
| Termokemi | ||||
| Std entalpi af forbrænding ΔcH |
-24.6 kJ/g | |||
| Sikkerhed | ||||
| EU klassifikation | Yderst brandfarligt (F+) Meget giftigt (T+) Skadeligt for miljøet (N) | |||
| NFPA 704 |
| |||
| R-sætninger | R12, R26, R27, R28, R32 | |||
| S-sætninger | S1, S2, S7, S9, S13, S16, S28, S29, S45 | |||
| Flammepunkt | 17.78 °C | |||
| Selvantændelses- temperatur |
538 °C | |||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | ||||
Blåsyre eller hydrogencyanid er en kemisk forbindelse, som har den kemiske formel HCN. Blåsyre er en farveløs, yderst giftig og flygtig substans, som har kogepunkt lige over stuetemperatur, ved 26 °C. Den har en svag duft af bitre mandler, som nogle mennesker ikke er i stand til at lugte. Blåsyre er en svag syre, som ioniseres i vand og danner cyanidioner, CN-. Salte af blåsyre kaldes cyanider. HCN er et vigtigt startmolekyle i syntesen af mange biologiske molekyler, som f.eks. polymerer og lægemidler.
Kemiske reaktioner
Cyanidioner kan adderes til ketoner, hvorved der dannes cyanohydriner. Denne reaktion foregår ved syntesen af aminosyrer, bl.a. den essentielle aminosyre methionin.
HCN kan også adderes til alkener, hvorved der dannes nitriller. Denne reaktion kaldes hydrocyanering.
Forekomst og anvendelse
Frugter der har kerner, såsom kirsebær, abrikoser, bittermandler og æbler, indeholder små mængder af cyanohydriner, som f.eks. mandelonitril, hvorfra der langsomt frigives blåsyre.[1],[2]
Blåsyre hva fand lever du her? anvendes bl.a. til insektgifte (f.eks. Zyklon B), sprængstoffer, maling og, i USA ved udførelsen af dødsstraf i gaskammer.
Nogle tusindben frigiver blåsyre som forsvarsmekanisme [3]. Dette er også tilfældet for nogle insekter. Der findes HCN i udstødnings-, tobaks- og brænderøg, og PUJORTARTARTUT TIPITTORSUUPPUT!! i røg fra afbrænding af kvælstof-holdige plasticforbindelser.har du en store batterier??
Anvendelse i kemisk krigsførelse
En blåsyrekoncentration på få hundrede ppm i luft vil slå et menneske ihjel i løbet af få minutter[4]. Giftigheden skyldes cyanidionen, der forhindrer den cellulære respiration. Mest kendt som middel i kemisk krigsførelse er blåsyre nok under navnet Zyklon B, der blev brugt af Hitlers nazi-regime til udryddelsen af jøder og andre politiske modstandere under 2. verdenskrig.
Se også
Kilder
- ^ J. Vetter (2000). "Plant cyanogenic glycosides". Toxicon. 38: 11-36. doi:10.1016/S0041-0101(99)00128-2.
- ^ D. A. Jones (1998). "Why are so many food plants cyanogenic?". Phytochemistry. 47: 155-162. doi:10.1016/S0031-9422(97)00425-1.
- ^ M. S. Blum, J. P. Woodring (1962). "Secretion of Benzaldehyde and Hydrogen Cyanide by the Millipede Pachydesmus crassicutis (Wood)". Science. 138: 512-513. doi:10.1126/science.138.3539.512.
- ^ Chang, Raymond (2004). Chemistry (8th udgave). McGraw-Hill. s. 879. ISBN 0-07-111318-5.
