Kemisk stof

Et kemisk stof (kemikere foretrækker betegnelsen rent stof) er et materiale med en bestemt kemisk sammensætning, uanset om det er naturligt eller kunstigt fremstillet.[1] Eksempelvis har alle prøver af rent vand samme egenskaber og samme forhold mellem hydrogen og oxygen, uanset om prøven er isoleret fra en flod eller fremstillet i et laboratorium. Et rent stof kan ikke opdeles i andre stoffer ved nogen mekanisk proces.[2] Kemiske stoffer, der typisk findes i et hjem er vand, bordsalt (natriumchlorid) og sukker (sucrose). Generelt kan kemiske stoffer eksistere i tre forskellige tilstandsformer: som fast stof, væske eller gas, afhængig af temperatur og tryk.
Konceptet kemisk stof blev endeligt fastlagt i slutningen af 1800-tallet på grundlag af kemikeren Joseph Prousts arbejde med sammensætningen af rene kemiske stoffer såsom basisk kobbercarbonat.[3] Han udledte at: "All samples of a compound have the same composition; that is, all samples have the same proportions, by mass, of the elements present in the compound" (dansk: "Alle udtagne prøver af et stof har den samme sammensætning, dvs. alle prøver har samme massefordeling af grundstoffer til stede i stoffet.") Dette blev kendt som Loven om konstant sammensætning, og det er en af grundstenene i moderne kemi.
Grundstoffer
[redigér | rediger kildetekst]Et stof består af atomer, der igen består af negativt ladede elektroner, der er centreret omkring en atomkerne bestående af positivt ladede protoner og neutrale neutroner. I et grundstof har alle atomerne samme antal protoner, men de enkelte atomer kan være forskellige isotoper af grundstoffet ved at have forskelligt antal neutroner.
Der findes omkring 120 kendte grundstoffer, hvoraf ca. 80 er stabile, dvs. de ændrer sig ikke til andre grundstoffer ved radioaktivt henfald. Størstedelen af grundstofferne er klassificeret som metaller, og eksempler på disse er jern (Fe), kobber (Cu) og guld (Au). Metaller er typisk elektrisk ledende og varmeledende.[4] Ca. 12 grundstoffer[5] såsom kulstof (C), nitrogen (N2) og oxygen (O2) er klassificeret som ikke-metaller. Ikke-metaller mangler de ovenfor beskrevne egenskaber, og de har typisk også en høj elektronegativitet og en tendens til at danne anioner, i modsætning til metaller, der danner kationer. Den resterende gruppe grundstoffer, herunder silicium (Si), har både metal- og ikke-metalegenskaber, og disse stoffer kaldes derfor halvmetaller eller metalloider.
Kemiske forbindelser
[redigér | rediger kildetekst]Kemiske forbindelser er stoffer, hvor atomer fra to eller flere grundstoffer er bundet til hinanden som molekyler eller i et salt. Ved at kombinere atomer fra ca. 120 grundstoffer får man et enormt antal mulige kemiske forbindelser. P.t. er omkring 30 millioner forskellige kemiske forbindelser blevet karakteriseret og identificeret, og tallet er kraftigt stigende.[6] Forbindelser baseret på kulstof- og hydrogen-atomer kaldes organiske forbindelser, mens andre forbindelser kaldes uorganiske forbindelser, men grænsen mellem de to typer forbindelser er ikke helt skarp. Organiske forbindelser med bindinger mellem et C-atom og et metalatom kaldes metalorganiske forbindelser.
Forbindelser, der udelukkende holdes sammen af kovalente bindinger, dvs. bindinger hvor atomerne deles om fælles elektroner, kaldes kovalente forbindelser, mens forbindelser med ionbindinger, altså bindinger mellem modsat ladede atomer uden fælles elektroner, kaldes salte eller ioniske forbindelser. Der findes imidlertid mange mellemtilfælde, hvor man kan tale om bindinger med mere eller mindre ionisk karakter.
Stoffer og blandinger
[redigér | rediger kildetekst]Alt stof består af grundstoffer og kemiske forbindelser, men ofte som blandinger af stofferne. Blandinger indeholder mere end et kemisk stof, og de har ikke nødvendigvis en bestemt sammensætning. I princippet kan stofferne i blandingen adskilles ved rent mekaniske processer, men i praksis er det ikke altid muligt. Saltvand, smør, jord og træ er eksempler på blandinger.
Gråt jern og gult svovl er begge grundstoffer, og de kan blandes i et hvilket som helst forhold, hvorved der dannes en grågul blanding. Ved blandingen sker der ingen kemisk reaktion, dvs. de to stoffer forbliver rent jern og rent svovl, og de to stoffer kan adskilles igen ved en mekanisk proces, f.eks. ved brug af en magnet til at fjerne jernet fra svovlet.
Hvis jern og svovl derimod opvarmes i et bestemt forhold (56 gram (1 mol) jern til 32 gram (1 mol) svovl), sker der en kemisk reaktion, hvorved der dannes et nyt kemisk stof, jern(II)sulfid, med formlen FeS. Det dannede stof er ét kemisk stof (og dermed ikke en blanding), fordi det har sine egne helt særlige egenskaber såsom smeltepunkt og opløseligehed. Den oprindelige blanding af to komponenter er dermed omdannet til én kemisk forbindelse, og de oprindelige komponenter kan derfor ikke udskilles ved mekaniske processer.
Navngivning af kemiske stoffer
[redigér | rediger kildetekst]Ethvert kemisk stof har et systematisk navn, som regel navngivet efter IUPAC's navngivningsregler. Et alternativt navngivningssystem anvendes af Chemical Abstracts Service (CAS).
Mange stoffer er dog primært kendt under et mere almindeligt og enklere navn, også kaldet et trivialnavn, der er opstået inden indførelsen af systematiske navne, og som har overlevet på grund af dets høje udbredelse. F.eks. har det kendte sukkerstof glucose nu det systematiske navn 6-(hydroxymethyl)oxane-2,3,4,5-tetrol, men det ses kun meget sjældent. Naturstoffer og medicinalstoffer har normalt også simple navne, f.eks. har det smertestillende stof naproxen det systematiske navn (S)-6-methoxy-α-methyl-2-naphthaleneddikesyre.
Kemikere refererer ofte til kemiske forbindelser ved brug af kemiske formler, som giver en mere explicit information om forbindelsens kemiske struktur. Der er blevet udviklet it-systemer til håndtering af sådanne strukturer, herunder CAS-numre, SMILES og som det nyeste International Chemical Identifier (InChI). Udover at blive brugt i elektroniske databaser, er især CAS-numrene blevet meget anvendt i værker på papir til at identificere specifikke forbindelser.
Identifikation af et typisk kemisk stof Alm. navn Systematisk navn Sumformel Strukturformel CAS-nummer InChI alkohol, ætylalkohol eller
ethanolethanol C2H5OH 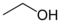
[64-17-5] 1/C2H6O/c1-2-3/h3H,2H2,1H3
Isolering, oprensning, karakterisering og identifikation
[redigér | rediger kildetekst]En almindelig kemisk arbejdsopgave er at isolere et stof fra en blanding, f.eks. ekstraktion af et bestemt stof fra en naturkilde (hvor en prøve ofte indeholder adskillige kemiske forbindelser) eller efter en kemisk reaktion (som ofte giver blandinger af kemiske forbindelser). Dette sker som regel ved fysiske processer såsom destillation, filtrering, ekstraktion og inddampning. Sammen med andre oprensningsteknikker som rekrystallisation, kromatografi o.lign. kan det ofte lade sig gøre fjerne urenheder fra stoffet og dermed udvinde meget rene stoffer. Og når det rene stof er oprenset, kan det karakteriseres ved at undersøge dets kemiske og fysiske egenskaber. Endelig kan kemisk analyse anvendes til identificere stoffet og anslå dets renhed.
Eksterne links
[redigér | rediger kildetekst]- IUPAC Compendium of Chemical Terminology - the Gold Book Arkiveret 24. januar 2010 hos Wayback Machine
Referencer og noter
[redigér | rediger kildetekst]- ^ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., p5, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ^ Ebbing, D. D.; Gammon, S. D. General Chemistry, 7th ed., p12, Houghton Mifflin, Boston, Massachusetts, 2002.
- ^ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., p37, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ^ Hill, J. W.; Petrucci, R. H.; McCreary, T. W.; Perry, S. S. General Chemistry, 4th ed., pp45-46, Pearson Prentice Hall, Upper Saddle River, New Jersey, 2005.
- ^ Grænsen mellem matalloider og ikke-metaller er ikke helt klar, som beskrevet i foregående reference.
- ^ "Chemical Abstracts substance count". Arkiveret fra originalen 5. december 2000. Hentet 25. august 2006.

