Skeletmuskulatur
| Skeletmuskel Skeletale tværstribet muskel Tværstribet frivillig muskel | |
|---|---|
 En skeletmuskel set fra oven. | |
| Detaljer | |
| Latin | muscularis striatus skeletalis |
| TH | H2.00.05.2.00002 |
| Anatomisk terminologi | |
Skeletmuskulatur er en af tre store muskeltyper, de andre er hjertemuskulatur og glat muskulatur. Det er en form for tværstribet muskulatur der er under 'frivillig' kontrol af det somatiske nervesystem.[1] De fleste skeletmuskler er forbundet til knoglens ender med kollagenfibre kendt som sener.
En skeletmuskel referer til flere bundter af celler kaldet muskelfibre (fascikler). Fibrene og musklerne er omkredset af bindevævslag kaldet fascie. Muskelfibre, eller muskelceller, dannes fra fusionen af udviklingsparate myoblaster i en proces kendt som myogenese. Muskelfibre er cylindriske og har mere end én cellekerne. Den har flere mitokondrier for at kunne klare energikravene.
Muskelfibre består derimod af myofibriller. Myofibrillerne består af aktin- og myosin-filamenter, gentaget i grupper kaldet sarkomere, der er den basale funktionelle gruppe i muskelfibrene. Sarkomerne er årsagen til det tværstribede udseende på skeletmuskler, og danner det basale maskineri der kræves for at lave en muskelkontraktion.
Skeletmuskler
[redigér | rediger kildetekst]Bindevæv er tilstede i alle muskler som fascier. Omkring hver muskel er et lag af bindevæv kendt som epimysium; omkring hver fascikel er et lag kaldet perimysium, og omkring hver muskelfiber er et lag af bindevæv kaldet endomysium.
Muskelfibre
[redigér | rediger kildetekst]

Muskelfibre er de individuelle kontraktile dele inde i musklen. En eneste muskel, såsom biceps brachii indeholde mange muskelfibre.
En anden gruppe af celler, myosatellitceller findes mellem basalmembranen og sarkolemma i muskelfibrene.[2] Disse celler er normalt hvilende, men kan blive aktiveret af fysisk aktivitet eller patologi for at give yderligere myonuclei til muskelvækst eller reparation.
Udvikling
[redigér | rediger kildetekst]Individuelle muskelfibre bliver dannet under udvikling fra fusionen af flere udifferentierde umodne celler kendt som myoblaster til lange cylindriske multikernede celler. Differentieringen til dette stadie er primært færdiggjort før fødslen, hvorefter celler fortsætter med at vokse i størrelse.
Mikroanatomi
[redigér | rediger kildetekst]Skeletmuskler viser et bestemt båndmønster når de ses under et mikroskop, på grund af fordelingen af cytoskeletale elementer i muskelfiberens cytoplasma. De principielle cytoplasmiskeproteiner er myosin og aktin (også kendt som "tykke" og "tynde" filamenter), der er fordelt i en gentaget gruppe kaldet sarkomere. Interaktionen mellem myosin og aktiv er ansvarlig for muskelkontraktion.
Hver eneste organel og makromolekyle i en muskelfiber er fordelt for at form møder funktion. Cellemembranen kaldes sarkolemma, og cytoplasma er kendt som sarkoplasma. I sarkoplasma findes myofibrillerne. Myofibrillerne er lange proteinbundter på omkring 1 mikrometer i diameter, der hver især indeholder myofilamenter. Presset mod indersiden af sarkolemma er de usædvanligt fladtrykte myonuclei. Mellem myofibrillerne er mitokondrierne.
Mens muskelfibrene ikke har et glat endoplasmatisk reticulum, har det et sarkoplasmatisk reticulum. Det sarkoplasmatiske reticulum omkranser myofibrillerne og holder på calcium-ion-reserverne der kræves for at lave en muskelkontraktion. Periodevis har det udvidet endesække kendt som terminala cisternae. Disse krydser muskelfibrene fra den ene side til den anden. Imellem to terminala cisternae er en tubulær indfoldning kaldet en transvers tubuli (T tubuli). T-tubuli er den vej aktionspotentialet signalere til det sarkoplasmatiske reticulum at det skal frigive calcium, hvorved en muskelkontraktion sker. Sammen, to terminala cisternae og en transvers tubuli, danner de en triade.[3]
Fordeling af muskelfibre
[redigér | rediger kildetekst]Muskelarkitektur refererer til fordelingen af muskelfibre relativt til kraftudviklingsaksen for musklen. Denne akse er en hypotetisk linje fra musklens udspring til dens insertion. Fra nogle longitudinale muskler, såsom biceps brachii, er dette et relativt simpelt koncept. For andre, såsom rectur femoris eller deltamusklen, bliver det mere kompliceret. Selvom muskelfibrene i en fascikel ligger parallelt med hinanden, kan fasciklerne selv varierer i deres forhold til hinanden og til deres sener.[4] De forskellige fiberfordelinger producerer brede kategorier af skeletmuskelarkitektur, herunder longitudinale, pennate, unipennate, bipennate og multipennate.[5] På grund af disse forskellige arkitekturer, kan spændingen en muskel kan skabe mellem dens sener, variere med mere end blot dens størrelse og fibertype.
Longitudinal arkitektur
[redigér | rediger kildetekst]Fascikler er longitudinalt fordelt, parallelt eller fusiformet muskler der løber parallelt med kraftudviklingsaksen, hvorfor disse muskler som en helhed fungerer som én stor muskelfiber.[4] Variationer eksisterer, og de forskellige termer er ofte brugt mere specifikt. Eksempelvis refererer fusiform til en longitudinal arkitektur med en bredere muskel midten (biceps), mens parallel kan referer til en mere sløjfeformet longitudinal arkitektur (rectus abdominis). Et mindre udbredt eksempel vil være en cirkulær muskel såsom orbicularis oris, i hvilken fibre er longitudinalt fordelt, men laver en cirkel fra udspring til insesering.
Unipennate arkitektur
[redigér | rediger kildetekst]Fibrene i unipennate muskler er alle orienteret mod den samme (men ikke-nul) vinkel relativ til kraftudviklingsaksen.[5] Men på grund af denne vinkel, kan flere fibre blive pakket ind i den samme muskelvolume, hvilket øger det fysiologiske krydsareal (PCSA). Denne effekt er kendt som fiberpakning, og i forhold til kraftudvikling mere end overvinder det effektivitetstabet fra non-akseorienteringen. Kompensationen kommer i samlet hastighed på muskelforkortningen og i total bevægelse. Samlet muskelforkortelseshastighed er reduceret sammenlignet med fiberforkortelseshastighed, det samme er distancen for forkortelsen.[5] Alle disse effekter skalerer med pennationsvinkel; større vinkler fører til større kraft på grund af forøget fiberpakning og PCSA, men med større tab i forkortelseshastighed og bevægelse. Vastus lateralis er et eksempel på unipennate arkitektur.
Multipennate arkitektur
[redigér | rediger kildetekst]Fibrene i multipennate muskler er fordelt i flere vinkler i relation til kraftudviklingsaksen, og er den mest generelle og mest almindelige arkitektur.[5] Flere fiberorienteringer hører til i denne kategori: bipennate, konvergent og multipennate. Selvom bestemmelsen af PCSA bliver mere besværlig i disse muskelarkitekturere, så er det samme kendetegn som beskrevet ovenfor.
Bipennate-fordelinger er essentielt "V"'er af fibre lagt ovenpå hinanden, såsom i rectus femoris.
Konvergente fordelinger er triangler eller blad-formet, med brede udspring og mere small insesering.[4] Den brede variation af pennationsvinkler i denne arkitektur kan faktisk tillade flere funktioner. Eksempelvis kan trapezius, en prototype på en konvergent muskel, hjælpe i både skulderhævning og -sænkning.
Multipennate-fordelinger er ikke begrænset til en bestemt fordeling, men, når det bruges specifikt, normalt refereret til som værende en kombination af bipennate eller unipennate med konvergente fordelinger. Et eksempel på denne arkitektur er den menneskelige deltoideus.
Funktion
[redigér | rediger kildetekst]Cellulær fysiolog og kontraktion
[redigér | rediger kildetekst]I tillæg til aktin og myosin-komponenter der er bestanddelene i sarkomerne, indeholder skeletmuskelfibrene også to andre vigtigt regulerende proteiner, troponin og tropomyosin, der er nødvendige for at muskelkontraktion sker. Disse proteiner er associeret med aktin og de virker sammen, for at forhindre dets interaktion med myosin. Skeletmuskelceller er exicatationsbare og underlagt depolarisering af neurotransmitteren acetylkolin, frigivet af det neuromuskulære junction af motorneuroner.[6]
Når en celle er tilstrækkeligt stimuleret, frigiver cellens sarkoplasmatisk reticulum ionisk calcium (Ca2+), der herefter interagerer med det regulerende protein troponin. Calciumbundet troponin undergår en konformationel ændring, der fører til bevægelsen af tropomysion, hvilket eksponerer myosinbindingssteder på aktin. Dette tillader myosin og aktin ATP-afhængigt tværgående cyklen og forkortelse af musklen.
Fysik
[redigér | rediger kildetekst]Muskelkraft er proportionel med fysiologisk krydsareal (PCSA)) og muskelstørrelse er proportionel med længden på muskelfibrene.[7] Drejningsmomentet omkring et led, er dog bestemt ud fra en vist antal biomekaniske parametre, blandt andet afstanden mellem muskelinseseringer og drejepunkter, muskelstørrelse og anatomisk gear ratio. Muskler er normalt fordelt i modsætningsforhold, sådan at når en gruppe af muskler kontrahere, vil en anden gruppe slappe af eller forlænges. Antagonisme i overførslen af nerveimpulser til musklen, betyder at det er umuligt at stimulerer kontraktionen af to antagonistiske muskler fuldstændigt, på samme tid. Ved ballistiske bevægelser, såsom at kaste, vil den antagonistiske muskel bremse agonistmusklen gennem kontraktionen, især i slutningen af bevægelsen. I eksemplet med kastet, vil brystet og forsiden af skulderen kontrahere for at trække armen fremad, mens musklerne i ryggen og bagerste af skulderen også kontrahere og undergår excentrisk kontraktion for at bremse bevægelsen ned, for at undgå skade. En del af træningsprocessen er at lære at hvile i antagonisten, for at øge kraftinputtet i brystet og den forreste del af skulderen.
Kontraherende muskler producerer vibration og lyd.[8] Langsomme fibre producerer 10 til 30 kontraktioner per sekund (10 til 30 Hz). Hurtige fibre producerer 30 til 70 kontraktioner per sekund (30 til 70 Hz).[9] Vibrationen kan ses og føles ved at stramme en muskel meget, såsom at lave en hård knytnæve. Lyden kan høres ved at presse den meget stramme muskel mod øret, igen er en hård knytnæve et godt eksempel. Lyden kan ofte beskrives som en rumlen. Nogle personer kan bevidst producere denne rumlen ved at kontrahere tensor tympani i midtøret. Rumlenen kan også høres hvis nakke- eller kæbemusklerne strammes meget.
Signaltransduktionsveje
[redigér | rediger kildetekst]Skeletmuskelfibretype fænotype hos voksne dyr er reguleret af flere uafhængige signalveje. Disse inkludere veje der involvere i Ras/mitogen-aktiveret proteinkinase-vejen (MAPK), calcineurin, calcium/calmodulin-afhængig proteinkinase IV, og peroxisom proliferator γ coaktivator 1 (PGC-1). Ras/MAPK signalvejen forbinder motorneuroner og signalsystemer, kobler eksitation og transkriptionsregulering for at fremme nerveafhængig induktion af det langsomme program i regenerering af muskler. Calcineurin, en Ca2+/calmodulin-aktiveret fosfatase impliceret i nerve aktivitetsafhængig fibertypespecifikation i skeletmuskler, kontrollere direkte fosforyleringsstadiet i transskriptionsfaktor NFAT, hvilket giver plads til dens translokation til kernen, og førende til aktiveringen af slow-type muskelproteiner i samarbejde med myocytforstærker-faktor 2-proteiner (MEF2) og andre regulatoriske proteiner. Ca2+/calmodulinafhængig proteinkinaseaktivitet er også opreguleret af aktivitet i de langsomme motorneuroner, muligvis fordi det forstærker slow-type calcineurin-genereret svar ved at fremme MEF2 transaktivatorfunktioner og forbedre oxidativ kapacitet gennem stimulering af mitokondriel biogenese.
Kontraktioninducerede ændringer i intracellulær calcium eller reaktive oxygendele giver signaler til forskelle signalveje der inkluderer MAPK'er, calcineurin og calcium/calmodulinafhængig proteinkinase IV for at aktivere transkriptionsfaktorer der regulerer genudtryk og enzymaktivitet i skeletmuskler.
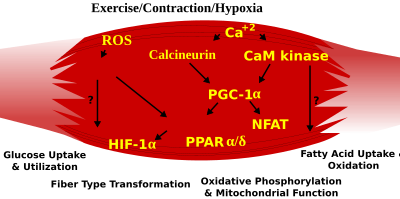
PGC1-α (PPARGC1A), en transkriptionel koaktivator af kernereceptorerer der er vigtig for reguleringen af et antal mitokondrielle gener involveret i oxidativ metabolisme, interagerer direkte med MEF for synergistisk at aktiverer selektive langsomme muskelgener og fungerer også som mål for calcineurin signallering. Et peroxisomproliferatoraktiveret receptor δ (PPARδ)-medieret transkriptionel signalvej er involveret i reguleringen af skeletmuskelfiber-fænotypen. Mus der har en aktiveret form for PPARd viser en "udholdenheds"-fænotype, med en koordineret øgning i oxidative enzymer og mitokondriel biogenese, og en øget del af langsomme fibre. Derfor, gennem funktionel genomic-calcineurin, danner calmodilinafhængigt kinase, PGC-1α, og aktiveret PPARδ basen for signalnetværket der kontrollerer skeletmuskelfibertypetransformation og metaboliske profiler der beskytter imod insulinresistens og fedme.
Skiftet fra aerobisk til anaerobisk metabolisme under intenst arbejde kræver at flere systemer hurtigt aktiveres for at sikker en konstant tilførsel af ATP til de arbejdende muskler. Disse inkluderer et skifte fra fedtbaseret til kulhydratbaseret brændstof, en omlægning af blodcirkulation fra ikke-arbejdende til arbejdende muskler, og fjernelsen af flere biprodukter af anaerob metabolisme, såsom kuldioxid og mælkesyre. Nogle af disse responser styres af transkriptionel kontrol af de hurtige glykolytiske fænotyper. Eksempelvis involverer skeletmuskelreprogrammeringen fra langsom glykolytisk fænotype til en hurtig glykolytisk fænotupe Six1/Eya1-komplekset, bestående af medlemmer af Six-proteinfamilien. Yderligere, er hypoxi-inducerende faktor 1-α (HIF1A) blevet identificeret som en master-regulator for gen-udtryk involveret i essentielle hypoxi-responser der vedligeholder ATP-niveauer i cellerne. Ablationaf HIF-1α i skeletmuskler var associeret med en øgning af aktiviteten i hastighedsbegrænsende enzymer i mitokondria, hvilket indikerer at citronsyrecyklussen og forøget fedtsyreoxidation kan kompensere for det nedsatte flow gennem den glykolytiske signalvej i disse dyr. Men, hypoxi-medieret HIF-1α-responser er også forbundet til reguleringen af mitokondriel dysfunktion gennem formationen af overdrevne reaktive oxygendele i mitokondriet.
Andre signalveje influerer voksen muskelform. Eksempelvis kan fysiske kræfter inde i muskelfibre frigive transkriptionsfaktor serum responsfaktor (SRF) from den strukturelle protein titin, hvilket fører til ændret muskelvækst.
Kliniske signifikans
[redigér | rediger kildetekst]Sygdomme i skeletmuskler kaldes myopatier, mens sygdom i nerverne kaldes neuropatier. Begge kan påvirke muskelfunktion og/eller være skyld i muskelsmerte, og falder under paraplyen neuromuskulær sygdom. Myopatier er blevet modelleret med cellekultursystemer af muskler fra sunde eller sygdomsramte vævsbiopsier. En anden kilde til skeletmuskel og stamceller kommer fra målrettet differentiering fra pluripotente stamceller.[10]
Forskning
[redigér | rediger kildetekst]Forskning i skeletmuskelegenskaber bruger mange teknikker. Elektisk muskelstimulation bruges til at fastslå kræft og kontraktionshastighed ved forskellige stimulationsfrekvenser, der er relateret til fibertyper-komposition og blanding inden for en individuel muskelgruppe. In vitro muskeltest bruges til mere komplet karakterisering af muskelegenskaber.
Den elektriske aktivitet der forbindes med muskelkontraktion måles via elektromyografi (EMG). EMG er en almindelig teknik brug i mange discipliner inden for bevægelsesforskning. Skeletmuskler har to fysiologiske responser: afslapning og kontraktion.[a] Mekanismerne for hvordan disse responser sker, generer elektrisk aktivitet målt ved EMG. Speficikt kan EMG måle aktionspotentialet i en skeletmuskel, der kommer fra hyperpolarisering af motor-axonerne fra nerveimpulser sendt til musklen. EMG bruges i forskning for at fastslå om den pågældende skeletmuskel aktiveres, mængde af kraft genereret, og en indikator på muskeltræthed.[11] De to typer af EMG er intramuskulær EMG, og den mest almindelige, overflade EMG. EMG-signalerne er meget større når en skeletmuskel kontrahere versus er afslappet. Men for mindre og dybere skeletmuskler er EMG-signalerne reduceret og derfor anses det som en mindre brugbar teknik for at måle aktivitet.[12] I forskning der bruger EMG, laves en maksimal frivillig kontraktion (MVC) normalt på den skeletmuskel man ønsker at undersøge, for at have referencedata til resten af EMG-målingerne under hovedtestningen af den samme skeletmuskel.[13]
Bente Klarlund Pedersen og hendes kollegaer har lavet forskning der viser at skeletmuskler fungerer som et endokrint organ ved at udskille cytokiner og andre peptider, nu refereret til som myokiner. Myokiner tænkes at mediere sundhedsfordelene ved fysisk aktivitet.[14]
Noter
[redigér | rediger kildetekst]- ^ The electrical activity associated with muscle contraction are measured via electromyography (EMG)[kilde mangler]
Se også
[redigér | rediger kildetekst]Referencer
[redigér | rediger kildetekst]- ^ Birbrair, Alexander; Zhang, Tan; Wang, Zhong-Min; Messi, Maria Laura; Enikolopov, Grigori N.; Mintz, Akiva; Delbono, Osvaldo (2013-03-21). "Role of Pericytes in Skeletal Muscle Regeneration and Fat Accumulation". Stem Cells and Development. 22 (16): 2298-2314. doi:10.1089/scd.2012.0647. ISSN 1547-3287. PMC 3730538. PMID 23517218.
- ^ Zammit, PS; Partridge, TA; Yablonka-Reuveni, Z (november 2006). "The skeletal muscle satellite cell: the stem cell that came in from the cold". Journal of Histochemistry and Cytochemistry. 54 (11): 1177-91. doi:10.1369/jhc.6r6995.2006. PMID 16899758.
- ^ Saladin, Kenneth S. (2010). Anatomy and Physiology (3rd udgave). New York: Watnick. s. 405-406. ISBN 9780072943689.
- ^ a b c Martini, Frederic H.; Timmons, Michael J.; Tallitsch, Robert B. (2008). Human Anatomy (6 udgave). Benjamin Cummings. s. 251-252. ISBN 978-0-321-50042-7.
- ^ a b c d Lieber, Richard L. (2002) Skeletal muscle structure, function, and plasticity. Wolters Kluwer Health.
- ^ Costanzo, Linda S. (2002). Physiology (2nd udgave). Philadelphia: Saunders. s. 23. ISBN 0-7216-9549-3.
- ^ Quoted from National Skeletal Muscle Research Center; UCSD, Muscle Physiology Home Page – Skeletal Muscle Architecture Arkiveret 18. juli 2014 hos Wayback Machine, Effect of Muscle Architecture on Muscle Function
- ^ Barry, D. T. (1992). "Vibrations and sounds from evoked muscle twitches". Electromyogr Clin Neurophysiol. 32 (1-2): 35-40. PMID 1541245.
- ^ [1] Arkiveret 31. december 2016 hos Wayback Machine, Peak Performance – Endurance training: understanding your slow twitch muscle fibres will boost performance
- ^ Chal J, Oginuma M, Al Tanoury Z, Gobert B, Sumara O, Hick A, Bousson F, Zidouni Y, Mursch C, Moncuquet P, Tassy O, Vincent S, Miyanari A, Bera A, Garnier JM, Guevara G, Hestin M, Kennedy L, Hayashi S, Drayton B, Cherrier T, Gayraud-Morel B, Gussoni E, Relaix F, Tajbakhsh S, Pourquié O (august 2015). "Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy". Nature Biotechnology. 33: 962-9. doi:10.1038/nbt.3297. PMID 26237517.

- ^ Cè, E; Rampichini, S; Limonta, E; Esposito, F (10. december 2013). "Fatigue effects on the electromechanical delay components during the relaxation phase after isometric contraction". Acta physiologica (Oxford, England). 211 (1): 82-96. doi:10.1111/apha.12212. PMID 24319999.
- ^ Xu, Q; Quan, Y; Yang, L; He, J (januar 2013). "An adaptive algorithm for the determination of the onset and offset of muscle contraction by EMG signal processing". IEEE transactions on neural systems and rehabilitation engineering : a publication of the IEEE Engineering in Medicine and Biology Society. 21 (1): 65-73. doi:10.1109/TNSRE.2012.2226916. PMID 23193462.
- ^ Milder, DA; Sutherland, EJ; Gandevia, SC; McNulty, PA (2014). "Sustained maximal voluntary contraction produces independent changes in human motor axons and the muscle they innervate". PLoS ONE. 9 (3): e91754. Bibcode:2014PLoSO...991754M. doi:10.1371/journal.pone.0091754. PMC 3951451. PMID 24622330.
- ^ Pedersen, B. K. (2013). "Muscle as a Secretory Organ". Comprehensive Physiology. Comprehensive Physiology. Vol. 3. s. 1337-62. doi:10.1002/cphy.c120033. ISBN 9780470650714. PMID 23897689.
