Natriumazid
| Natriumazid | ||||
|---|---|---|---|---|
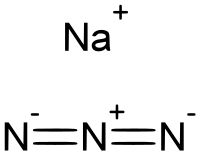
| ||||
| Generelt | ||||
| Systematisk navn | Natriumazid | |||
| Andre navne | Natriumtrinitrid | |||
| Molekylformel | NaN3 | |||
| Molmasse | 65.0099 g/mol | |||
| CAS nummer | [26628-22-8] | |||
| PubChem | ||||
| Egenskaber | ||||
| Massefylde | 1.846 g/cm3 (20 °C) | |||
| Opløselighed i alkohol | 41.0 g/100 mL (15 °C) | |||
| Smeltepunkt | 275 °C | |||
| Kogepunkt | −33.34 °C | |||
| Syrestyrkekonstant (pKa) | 4,8 | |||
| Struktur | ||||
| Sikkerhed | ||||
| MSDS | External MSDS | |||
| EU klassifikation | Meget giftig (T+) Meget skadelig for miljøet (N) | |||
| NFPA 704 |
| |||
| R-sætninger | R28, R32, R50/53 | |||
| S-sætninger | (S1/2), S28, S45, S60, S61 | |||
| Flammepunkt | 300 °C | |||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | ||||
Natriumazid er en uorganisk forbindelse med formlen NaN3. Dette farveløse salt bliver brugt som det gasdannende komponent i mange airbags til biler. Det bliver brugt til at fremstille andre azidforbindelser. Det er en ionisk forbindelse, der er meget opløselig i vand og akut giftig.
Struktur og fremstilling[redigér | rediger kildetekst]
Natriumazid er et ionisk fast stof. To polymorfe krystalstrukturer kendes; rhombohedral og hexagonal.[1][2] Azidanionen er meget ens, da de er centrosymmetriske med en afstand i N–N-bindingen på 1.18 Å. Na+-ionen er pentakoordineret.
Den mest almindelige syntesemetode er "Wislicenusprocessen", som foregår i to trin fra ammoniak. I første trin bliver ammoniak omdannet til natriumamid:
- 2 Na + 2 NH3 → 2 NaNH2 + H2
Natriumamidet bliver efterfølgende kombineret med Dinitrogenoxid:
- 2 NaNH2 + N2O → NaN3 + NaOH + NH3
Alternativt kan saltet fremstilles ved reaktionen mellem natriumnitrat og natriumamid.[3]
Anvendelse[redigér | rediger kildetekst]
Airbags og evakueringsslisker i fly[redigér | rediger kildetekst]
Ældre airbags indeholder en blanding af oxidationsmidler og natriumazid og andre komponenter som tændsatser og accelerationsmidler. En elektronisk anordning detonerer blandingen ved et færdselsuheld:
- 2 NaN3 → 2Na + 3 N2
Samme reaktion sker ved at opvarme saltet til omkring 300 °C. Natriummet som bliver dannet er potentielt farligt alene idet det reagerer voldsomt med vand, der findes i atmosfæren. Derfor bliver det omdannet ved en reaktion med andre komponenter som natriumnitrat og silica, ved brug i bilairbags. I sidstnævnte tilfælde bliver der dannet uskadelige natriumsilikater.[4] Natriumazid bliver også brugt til evakueringsslisker på flyv. Nyere typer airbags indeholder nitroguanidin eller lignende mindre sensitive eksplosiver.
Organisk og uorganisk syntese[redigér | rediger kildetekst]
Som følge af stoffets eksplosionsfare har natriumazid kun begrænset anvendelse i den industrielle skala af organisk kemi. I laboratoriet bliver det brugt til organisk syntese til at introducere funktionelle azidgrupper ved udskiftning af halider. Den funktionelle axidgruppe kan herefter bliver omdannet til en amin ved reduktion med enten lithiumaluminium hydrid eller en tertiær fosfin, som triphenylfosfin i Staudingerreaktionen, med Raney nikkel eller med hydrogensulfid i pyridin.
Jernaxid er en alsidig precursor til andre uorganisk azidstoffer som blyazid og sølvazid som bliver brugt som sprængstoffer.
Brug i biokemi og biomedicin[redigér | rediger kildetekst]
Natriumazid er et nyttigt probereagens, mutagen og konserveringsmiddel. På hospitaler og laboratorier er det et biocid; det er et særlig vigtigt bulkreagens til tamopløsninger som kan være udsat for bakterievækst, hvor natriumazid fungerer som bakteriostatika ved at inhibere cytochromoxidase i gram-negative bakterier; gram-positive (Streptokok, Streptococcus pneumoniae, lactobaciller) er resistente.[5] Det bliver også brugt i landbrug til skadedyrsbekæmpelse.
Azid inhiberer cytochromoxidase ved at binde irreversibelt til heme Cofaktoren i en proces, der ligner virkningen af carbonmonooxid. Natriumazid påvirker i særlig grad organer, der undergår høje mængder respiration som hjertet og hjernen.
Reaktioner[redigér | rediger kildetekst]
Behandling af natriumazid med stærke syrer giver hydrogenazid, som også er yderst giftig:
- H+ + N3- → HN3
Vandige opløsninger indeholder små mængder hydrogenazid, som beskrevet af følgende ligevægt:
- N3- + H2O ⇔ HN3 + OH- (K = 10−4.6)
Natriumazid kan blive ødelagt ved behandling med salpetersyrling:[6]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Sikkerhed[redigér | rediger kildetekst]
Natriumazid er kraftig gift. Den kan være fatal, hvis den kommer i kontakt med hud eller bliver indtaget. Selv små mængder kan give symptomer på forgiftning. Giftigheden af dette stof er sammenlignelig med opløselige alkalicyanider og den dødelige dosis for et voksent menneske er 0,7 gram.[7] Der foreligger ikke rapporter om, at giften er blevet spredt fra udløste airbags.[8]
Referencer[redigér | rediger kildetekst]
- ^ Stevens E. D., Hope H. (1977). "A Study of the Electron-Density Distribution in Sodium Azide, NaN3". Acta Crystallographica A. 33 (5): 723-729. doi:10.1107/S0567739477001855.
- ^ Wells, A. F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, ISBN 0-19-855370-6
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ Betterton, E. A. (2003). "Environmental Fate of Sodium Azide Derived from Automobile Airbags". Critical Reviews in Environmental Science and Technology. 33 (4): 423-458. doi:10.1080/10643380390245002.
- ^ Lichstein, H. C.; Soule, M. H. (1943). "Studies of the Effect of Sodium Azide on Microbic Growth and Respiration: I. The Action of Sodium Azide on Microbic Growth". Journal of Bacteriology. 47 (3): 221-230. PMC 373901. PMID 16560767.
{{cite journal}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (1995). "Disposal of Waste". Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washington, DC: National Academy Press. s. 165. ISBN 0-309-05229-7.
{{cite book}}: CS1-vedligeholdelse: Flere navne: authors list (link) - ^ "MSDS: sodium azide". Mallinckrodt Baker. 2008-11-21. MSDS S2906.
- ^ Olson, K. R. (2007). Poisoning and Drug Overdose. McGraw-Hill Professional. s. 123. ISBN 0-07-144333-9.
