Ætanol: Forskelle mellem versioner
EmausBot (diskussion | bidrag) m r2.7.3) (Robot tilføjer new:इथानोल |
Jeppesn (diskussion | bidrag) For sundhedsmæssige aspekter af ætanol som nydelsesmiddel se artiklen alkohol. |
||
| Linje 60: | Linje 60: | ||
| SeOgsåForb = [[Methanol]], [[propanol]] |
| SeOgsåForb = [[Methanol]], [[propanol]] |
||
}} |
}} |
||
: ''For sundhedsmæssige aspekter af ætanol som nydelsesmiddel se artiklen [[alkohol]].'' |
|||
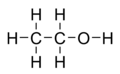
'''Ætanol''' eller '''ethanol''' ([[Kemisk Ordbog]]), samt '''ethylalkohol''', '''ætylalkohol''' eller '''vinånd''', er en [[organisk forbindelse]] med [[Sumformel|sumformlen]] CH<SUB>3</SUB>CH<SUB>2</SUB>OH som forkortes '''EtOH'''. Det er en farveløs, brandfarlig væske med en stikkende lugt. Ethanol bruges til [[spirituosa|spiritus]], [[vin]], [[øl]], samt som [[opløsningsmiddel]] i den [[kemisk industri|kemiske industri]]. |
'''Ætanol''' eller '''ethanol''' ([[Kemisk Ordbog]]), samt '''ethylalkohol''', '''ætylalkohol''' eller '''vinånd''', er en [[organisk forbindelse]] med [[Sumformel|sumformlen]] CH<SUB>3</SUB>CH<SUB>2</SUB>OH som forkortes '''EtOH'''. Det er en farveløs, brandfarlig væske med en stikkende lugt. Ethanol bruges til [[spirituosa|spiritus]], [[vin]], [[øl]], samt som [[opløsningsmiddel]] i den [[kemisk industri|kemiske industri]]. |
||
Versionen fra 21. dec. 2012, 11:56
| Ethanol | |||
|---|---|---|---|
| IUPAC-navn Ethanol | |||
| Generelt | |||
| Andre navne | Ethylalkohol Finsprit | ||
| Forkortelser | EtOH | ||
| Molekylformel | CH3CH2OH | ||
| Molarmasse | 46,07 g/mol | ||
| Fremtræden | Farveløs væske | ||
| CAS-nummer | |||
| EC-nummer | 200-578-6 | ||
| PubChem | |||
| SMILES | CCO | ||
| InChI | 1/C2H6O/c1-2-3/h3H,2H2,1H3 | ||
| Kemiske egenskaber | |||
| Massefylde | 0,789 g/cm3 | ||
| Opløselighed i vand | Blandbar | ||
| Smeltepunkt | −114,3 °C | ||
| Kogepunkt | 78,4 °C | ||
| Syrestyrkekonstant (pKa) | 15,9 | ||
| Refraktionsindeks | 1,36 (25 °C) | ||
| Viskositet | 1,200 cP (1.200 mPa·s) (20 °C) | ||
| Struktur | |||
| Dipolmoment | 1,69 D (gas) | ||
| Sikkerhed | |||
| EU klassifikation | Brandfarlig (F) Sundhedsskadelig (Xn) | ||
| NFPA 704 | |||
| R-sætninger | R11 R61 | ||
| S-sætninger | S2 S7 S16 | ||
| Flammepunkt | 13 °C | ||
| Beslægtede stoffer | |||
| Relaterede forbindelser | Methanol, propanol | ||
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |||
- For sundhedsmæssige aspekter af ætanol som nydelsesmiddel se artiklen alkohol.
Ætanol eller ethanol (Kemisk Ordbog), samt ethylalkohol, ætylalkohol eller vinånd, er en organisk forbindelse med sumformlen CH3CH2OH som forkortes EtOH. Det er en farveløs, brandfarlig væske med en stikkende lugt. Ethanol bruges til spiritus, vin, øl, samt som opløsningsmiddel i den kemiske industri.
Ethanol bliver i dagligdagssproget også kaldt alkohol eller sprit. Ethanol blev også tidligere kaldt for vinånd, men denne betegnelse bruges stort set ikke i dag (men er dog gyldig stavemåde ifølge Retskrivningsordbogen).
Der er en del diskussion om stavemåden for stoffet:
- Ethanol er langt den mest udbredte stavemåde (og den eneste blandt kemikere) og det er også den stavemåde, som Kemisk Ordbog anbefaler.
- Ætanol eller ætylalkohol er de eneste stavemåder som er i Retskrivningsordbogen, men betragtes som forældet ifølge Kemisk Ordbog.
Fremstilling
Ethanol dannes som et affaldsprodukt ved gæring/alkoholfermentering af kulhydrater som f.eks. sukker eller stivelse reduceret til forgærbare kulhydrater. Når koncentrationen af ethanol er nået ca. 16% kan gærsvampene ikke gære mere, derfor har de fleste øl og vine en ethanolkoncentration på maksimum ca. 16%.
Spiritus og finsprit fås ved at destillere ethanolholdige væsker. Ved almindelig destillation kan maksimalt opnås en ethanolprocent på 96%. Ethanol med en renhed på over 96% kan kun fremstilles ved specielle tekniske metoder. 99% ethanol eller derover kaldes absolut ethanol eller finsprit.
Ethanol kan også fremstilles ved addition af vand over dobbeltbindingen i ethen (H2C=CH2). Reaktionen foregår i sur vandig opløsning. Dobbeltbindingen i ethen bliver angrebet af H+ så der dannes en carbokation. H2O fungerer som en nukleofil elektrondonor, og til sidst tabes der en proton. Derved har man fremstillet etanol.
Konsumering
Ethanol anvendes også i mad, særligt i drikkevarer, og tjener her til at beruse indtageren. Karakteristisk for denne forgiftningstilstand er nedsatte motoriske og mentale evner og ofte en vis følelse af behag. Symptomernes styrke kan variere alt efter, hvor meget ethanol personen har indtaget. For en bedre gennemgang af dette se alkoholpromille.
I madlavning koges udvalgte produkter med vin og spiritus. Det er en almen misforståelse, at maden vil være uden alkohol, da ætanols lave kogepunkt hurtigt får det til at fordampe, når det varmes. En undersøgelse fandt dog, at meget af alkoholen forbliver: 25 % efter 1 time af bagning eller simren, og 10 % efter 2 timer.[1]
Ethanols katabolisme i organismen resulterer i et energiudbytte på 7 kcal/g, og omsættes med en hastighed svarende til ca. 0,1 g/kg legemsvægt/time. Ethanol oxideres af alkoholdehydrogenase til acetaldehyd som videre oxideres til acetat (eddikesyre) af acetaldehyd dehydrogenase samt af xanthin oxidase, de to sidstnævnte enzymer hæmmes af et nedbrydningsprodukt af antabus, hvorved der sker en ophobning af acetaldehyd. Ved den uhæmmede reaktion (uden antabus) omdannes acetaten videre til acetyl-CoA som derefter omsættes i TCA-cyclen medens NADH oxideres videre i elektrontransportkæden.
Denaturering

Da ethanol er et nydelsesmiddel er det underlagt en ret høj skat. For at kunne sælge ethanol til andre formål uden beskatning, denatureres den (ofte), det vil sige at der tilsættes kemikalier, som gør ethanolen udrikkelig. Tidligere brugte man pyridin til husholdningssprit, men da det blev almindelig kendt, at det kunne fjernes med aktivt kul, gik man over til andre stoffer. For tiden er diethylphthalat det mest brugte i husholdningssprit. Hospitalssprit kan være denatureret med isopropylalkohol.
Desinfektion
Ethanol har også nogle egenskaber som gift, og anvendes flittigt til at desinficere med i både private husholdninger og laboratorier. Til at dræbe bakterier med er en ca. 70% ethanol tilstrækkelig. Flere undersøgelser viser at der ikke er den store forskel mellem f.eks. 90 % og 70 % opløsninger når det gælder bakterier.
Energilagring
I fremtiden kan det tænkes at man kan gemme energien i hydrogen som er besværligt at gemme – eller ethanol der er forholdsvist ugiftigt, miljøvenligt og let at opbevare. [2] [3] [4]
Bioethanol
- Se også bioethanol
Selvom Ethanol bliver til H2O og CO2 i forbrændingsmotorer og brændselsceller, kan Ethanol godt være CO2-neutralt, hvis CO2, som blev anvendt til at fremstille Ethanol, oprindeligt kom fra atmosfæren under forbrug af f.eks. solenergi (planter, solceller) eller fusion. Ethanol kaldes i så fald bioethanol.
Blanding af ethanol og vand
Et interessant eksperiment fås ved blanding af ethanol (husholdningssprit) (ca. 95%) og vand. Tag 1 liter af hver og bland det, resultatet er et rumfang mindre end 2 liter, mens massen er bevaret. [5] [6]
Anvendelser
- Brændstof
- Opløsningsmiddel:
- Parfume
- Hostesaft
- Kemisk syntese
- Brillepudsemiddel
- Anvendes som rensevæske til barbermaskiner sammen med parfume
- Anvendes ved nogle former for rengøring både i hjemmet og industrien og går så under betegnelsen husholdningssprit eller sprit (Har et ethanolindhold på ca. 93%). Det anvendes f.eks. til rengøring af:
- Desinfektionsmiddel: den optimale desinficerende koncentration er 70% ethanol (hospitalssprit).
Kilder/referencer
- ^ "Does alcohol burn off in cooking?". Ochef.com. Hentet 2009-08-29.
- ^ Popular Mechanics – Crunching The Numbers On Alternative Fuels Citat: "...according to the DOE, the growing, fermenting and distillation chain actually results in a surplus of energy that ranges from 34 to 66 percent..."
- ^ Physicsweb: Fuel cells turn to alcohol
- ^ Cruising the Ethanol Highway
- ^ Ask A Scientist. Chemistry Archive: Mass, Volume, Alcohol, Water
- ^ Water and Alcohol Mixtures and "The Amazing Air Bubble"
Se også
Eksterne henvisninger
 |
Wikimedia Commons har medier relateret til: |
- 2003-12-05, Science Daily: Moderate Alcohol Consumption Linked To Brain Shrinkage Citat: "...found a link between low to moderate alcohol consumption and a decrease in the brain size of middle-aged adults..."Our findings do not support the hypothesis that low or moderate alcohol intake offers any protection against cerebral abnormalities or the risk of stroke in middle-aged adults."...The study was funded by the National Heart, Lung and Blood Institute..."
- 16.03.2003, Ing.dk: Et bedre helbred med alkohol Citat: "...Patologerne, der dissekerede lig af alkoholikere...bemærkelsesværdigt fri for forkalkning..."
- 25.01.2005, ing.dk: Alkohol holder hjernen frisk hos kvinder Citat: "...Alkohol synes gavnligt for helbredet – blot forudsat, at forbruget er moderat. Det nedsætter risikoen for hjerte-kar-sygdomme...Hun tør dog ikke ligefrem anbefale afholdspersoner at begynde at drikke for at holde hjernen frisk..."
- DRMK: Alkohol
- Biosite.dk: Ethanol