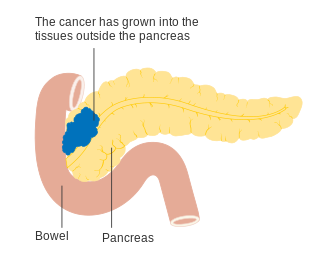
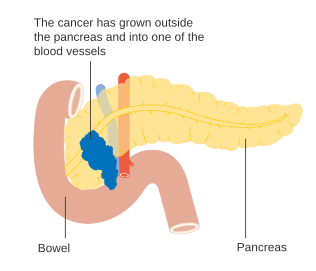
Bugspytkirtelkræft
| Bugspytkirtelkræft | |
|---|---|
 | |
| Diagram der viser placeringen af bugspytirtlen (Pancreas), bag mavesækken (Stomach), som er gjort transparent på dette billede. | |
| Klassifikation og eksterne ressourcer | |
| Speciale | Onkologi |
| ICD-10 | C25 |
| ICD-9-CM | 157 |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| MedlinePlus | 000236 |
| eMedicine | med/1712 |
| MeSH | D010190 |
Bugspytkirtelkræft (eller pankreaskræft[1]) opstår, når celler i bugspytkirtlen, en kirtel bag maven, begynder at mangedobles ude af kontrol og danne en masse. Disse kræftceller har evnen til at invadere andre dele af kroppen.[2] Der findes flere former for bugspytkirtelkræft. Den mest almindelige, adenokarcinom i bugspytkirtlen (også kaldet pankreatisk adenokarcinom), hvor et adenokarcinom vokser frem i den del af bugspytkirtlen, der producerer fordøjelsesenzymer, står for omkring 85% af alle tilfælde, og begrebet "bugspytkirtelkræft" anvendes nogle gange udelukkende om denne type. 1-2% af alle tilfælde af bugspytkirtelkræft er neuroendoktrine tumorer (forkortet "NET"), som opstår fra bugspytkirtlens hormonproducerende celler. Disse er generelt mindre aggressive end pankreatisk adenocarcinom.[3]
Blandt tegn og symptomer på den mest almindelige form for bugspytkirtelkræft er gullig hud, mave- eller rygsmerter, uforklarligt vægttab, lys afføring, mørk urin og mangel på appetit.[4] Der findes ingen symptomer i sygdommens tidlige stadier, og symptomer, der er specifikke nok til at pege i retning af bugspytkirtelkræft, viser sig typisk ikke før, at sygdommen er nået til et udviklet stadie.[4][5] Når diagnosen kan stilles, har bugspytkirtelkræften ofte spredt sig til andre dele af kroppen.[3][6]
Bugspytkirtelkræft opstår sjældent før 40-års-alderen, og mere end halvdelen af alle tilfælde af pankreatisk adenokarcinom rammer mennesker ældre end 70 år.[5] Blandt faktorer, der øger risikoen for at udvikle bugspytkirtelkræft, er tobaksrygning, fedme, diabetes og visse sjældne genetiske tilstande.[5] Omkring 25% af alle tilfælde er forbundet med rygning,[7] og 5–10% er forbundet med arvede gener.[5] Bugspytkirtelkræft diagnosticeres normalt ved en kombination af billedteknikker såsom ultralyd eller CT-scanning, blodprøver og undersøgelse af vævsprøver (biopsi).[7][8] Sygdommen opdeles i stadier, fra tidlig (stadie I) til sen (stadie IV).[6] Screening af den overordnede befolkning har ikke vist sig at være effektivt.[9]
Risikoen for at udvikle bugspytkirtelkræft er lavere blandt ikke-rygere og mennesker, der har en normal vægt og begrænser deres indtag af rødt og forarbejdet kød.[10] Rygeres risiko for at udvikle sygdommen falder, hvis de stopper med at ryge, og er efter 20 år næsten tilbage på niveau med resten af befolkningen.[3] Bugspytkirtelkræft kan behandles med kirurgi, radioterapi, kemoterapi, palliativ behandling eller en kombination af disse, ofte afhængig af kræftstadie. Kirurgi er den eneste behandlingsform, der kan helbrede pankreatisk adenokarcinom,[6] og kan også somme tider anvendes til at forbedre livskvalitet i de tilfælde, hvor en helbredelse ikke er mulig,[4][6] mens tidlig palliativ behandling anbefales til alle, selv til de der samtidig modtager behandling til forsøg på at helbrede sygdommen.[11][12] Somme tider er det herudover nødvendigt at supplere med smertebehandling og medicin til at hjælpe med fordøjelsen.[6]
I 2012 var bugspytkirtelkræft den syvendemest udbredte årsag til kræftrelaterede dødsfald med 330.000 dødsfald på verdensplan.[3] Det er den fjerdestørste årsag til kræftrelaterede dødsfald i Danmark både blandt mænd og kvinder.[13] Sygdommen forekommer oftere i den udviklede verden, som i 2012 stod for omkring 70% af alle nye tilfælde.[3] Pankreatisk adenocarcinom har typisk en meget dårlig prognose: efter diagnose overlever 25% et år og 5% overlever i fem år.[3][14] Hvad angår tidligt diagnosticeret kræft stiger femårs-overlevelsesraten til omkring 20%.[15] Neuroendokrine kræftformer har bedre udfald; her ligger femårs-overlevelsesraten på 65%, omend overlevelse varierer kraftigt afhængigt af typen af tumor.[3]
Former
[redigér | rediger kildetekst]
De mange former for bugspytkirtelkræft kan opdeles i to generelle grupper. Den overvældende majoritet af tilfælde (omkring 99%) sker i den del af bugspytkirtlen, som producerer fordøjelsesenzymer, kendt som 'eksokrine' del. Der findes flere undertyper af eksokrin bugspytkirtelkræft, men deres diagnose og behandling har meget til fælles. Den lille minoritet af kræft, der udvikler sig i bugspytkirtlens hormon-producerende (endokrine) væv, har anderledes kliniske egenskaber. Begge grupper rammer hovedsageligt (men ikke eksklusivt) mennesker på over 40 år og ses lidt oftere hos mænd, omend nogle sjældne undertyper hovedsageligt rammer kvinder eller børn.[16][17]
Eksokrine kræftformer
[redigér | rediger kildetekst]Den eksokrine gruppe er domineret af pankreatisk adenokarcinom (variationer heraf kan hedde "invasiv" eller "duktal", sidstnævnte fra det engelske ord "duct" betydende "kanal"), som er langt den mest udbredte form, og repræsenterer omkring 85% af alle tilfælde af bugspytkirtelkræft.[5] Næsten alle disse opstår i bugspytkirtlens kanaler, og forkortes derfor ofte PDAC (efter engelsk: pancreatic ductal adenocarcinoma) .[18] Dette sker til trods for, at det væv hvorfra kræftformen opstår – det pankreatiske duktale epitel – repræsenterer mindre end 10% af bugspytkirtlens volumen.[19] Denne kræftform stammer fra de kanaler, der transporterer sekreter (såsom enzymer og bicarbonater) væk fra bugspytkirtlen. Omkring 60–70% af alle adenocarcinoma opstår i bugspytkirtlens 'hoved'.[5]
Den næstmest udbredte form, acinære cellekarcinomer, opstår i de celleklynger, som producerer disse enzymer, og repræsenterer 5% af alle eksokrine bugspytkirtelkræfttilfælde.[20] Ligesom de 'fungerende' endokrine kræftformer beskrevet nedenfor, kan acinære cellekarcinomer forårsage overproduktion af bestemte molekyler, i dette tilfælde fordøjelsesenzymer, som kan føre til symptomer såsom hudkløe og ledsmerter.
Cystadenokarcinomer udgør 1% af alle tilfælde af bugspytkirtelkræft. Den har en bedre prognose end de andre eksokrine former.[20]
Pancreatoblastoma er en sjælden kræftform, der normalt opstår allerede i barndommen og har en relativt god prognose. Blandt andre eksokrine kræftformer er adenosquamøst karcinom, signetring-cellekarcinom , hepatoidcellulært karcinom, kolloidkarcinom, udifferentieret carcinom og udifferentieret carcinom med osteoklast-lignende kæmpeceller. Solid pseudopapillær tumor (SPT) er en sjælden, lavt-klassificeret neoplasi, der hovedsageligt rammer yngre kvinder og generelt har en meget god diagnose.[5][21]
Pankreatiske mucinøse cystiske neoplasier er en bred gruppe af bugspytkirteltumorer, der har varierende grader af malignt potentiale. De opdages i stadigt større omfang efterhånden som CT-scanning bliver mere kraftfuldt og bedre tilgængeligt, og der er fortsatte debatter omkring, hvordan de bedst kan vurderes og behandles, da mange af dem er benigne.[22]
Neuroendokrine kræftformer (PanNET'er)
[redigér | rediger kildetekst]Den lille minoritet af tumorer, der opstår andersteds i bugspytkirtlen, er hovedsageligt pankreatiske neuroendokrine tumorer (PanNET'er).[23] Neuroendokrine tumorer (NET'er) er en forskelligartet gruppe af benigne eller maligne tumorer, der opstår i kroppens neuroendokrine celler, som er ansvarlige for at integrere nervesystemet og det endokrine system. NET'er kan udvikle sig i de fleste af kroppens organer, heriblandt bugspytkirtlen, hvor de diverse maligne former alle betragtes som sjældne. PanNET'er grupperes i 'fungerende' og 'ikke-fungerende' former, afhængig af til hvilken grad de producerer hormoner. De fungerende former udskiller hormoner såsom insulin, gastrin og glucagon i blodbanen, ofte i store mængder, hvilket fører til alvorlige symptomer såsom lavt blodsukker, men også til relativt tidlig afsløring. De mest almindelige fungerende PanNET'er er insulinomer og gastrinomer, navngivet efter de hormoner de udskiller. De ikke-fungerende former udskiller ikke hormoner i stor nok kvantitet til, at det kan forårsage tydelige kliniske symptomer. Af denne grund diagnosticeres ikke-fungerende PanNET'er ofte først efter kræften har spredt sig til andre dele af kroppen.[24]
Tegn og symptomer
[redigér | rediger kildetekst]
Da bugspytkirtelkræft normalt ikke forårsager genkendelige symptomer i sine tidlige stadier, diagnosticeres sygdommen oftest ikke før, at den har spredt sig udover selve bugspytkirtlen.[8] Dette er en af hovedårsagerne til de overordnet set dårlige overlevelsesprocenter. Undtagelserne fra dette er de fungerende PanNET'er, hvor overproduktion af diverse aktive hormoner kan føre til symptomer.[25]
Blandt de symptomer på pankreatisk adenokarcinom, der oftest kan opstå før diagnose (der, som nævnt, sjældent stilles før 40-års-alderen), er:
- Smerter i den øvre del af maven eller ryggen, ofte spredt ud fra omkring maven og til ryggen. Smertens placering kan indikere den del af bugspytkirtlen, hvor der befinder sig en tumor. Smerten kan være værre om natten og kan øges med tiden til at blive alvorlig og konstant.[20] Den kan lindres en smule ved at bøje forover. I op mod 2/3 af alle tilfælde er mavesmerter det centrale symptom, heraf i 46% af tilfældene sammen med gulsot.[6]
- Gulsot, en gullig farvning af det hvide i øjnene eller af huden, samt mørk urin. Dette sker når en tumor i bugspytkirtlens hoved spærrer for den fælles galdegang, da denne løber gennem bugspytkirtlen.[26] I 13% af alle tilfælde af bugspytkirtelkræft er gulsot, uden mave- eller rygsmerter, det centrale symptom.[6]
- Uforklarligt vægttab, enten fra tab af appetitten, eller tab af eksokrin funktion, hvilket resulterer i dårlig fordøjelse.[6]
- Tumoren kan lægge tryk på nærliggende organer, forstørre fordøjelsesprocesser og gøre det svært for maven at blive tømt, hvilket kan føre til kvalme og en følelse af mæthed. Det ufordøjede fedt fører til dårligt-lugtende, fedtafføring som er svær at skylle ud i et toilet.[6] Forstoppelse ses ofte.[27]
- Mindst 50% af alle med pankreatisk adenokarcinom har diabetes ved diagnosticeringen.[5] Mens længerevarende diabetes er en kendt risikofaktor for bugspytkirtelkræft, kan kræften omvendt også selv forårsage diabetes, så en nyligt udbrudt diabetes kan være et tidligt tegn på bugspytkirtelkræft.[28] Mennesker, som udvikler diabetes efter 50-års-alderen, har otte gange større risiko for at udvikle pankreatisk adenokarcinom indenfor tre år, hvorefter den relative risiko falder.[6]
Andre observationer
[redigér | rediger kildetekst]- Trousseau's syndrom, hvor der spontant dannes blodpropper i portalblodlegemerne, de dybe vener i arme og ben, eller de overfladiske vener hvor som helst på kroppen, kan være forbundet med bugspytkirtelkræft og findes i omkring 10% af alle tilfælde.[7]
- Klinisk depression er blevet rapporteret i forbindelse med bugspytkirtelkræft i 10–20% af alle tilfælde og kan være en hindring for optimal håndtering af sygdommen. Depressionen rammer somme tider før kræftdiagnosen, hvilket tyder på, at den kan være forårsaget af kræftens biologi.[7]
Blandt andre ofte sete manifestationer af sygdommen er: svaghed og træthed; mundtørhed; søvnproblemer og en palpabel abdominal masse."[27]
Symptomer på spredning (metastase)
[redigér | rediger kildetekst]
Bugspytkirtelkræftens spredning til andre organer (såkaldt metastase) kan også forårsage symptomer. Normalt spredes pankreatisk adenokarcinom først til nærliggende lymfeknuder, og senere til leveren eller bughulen, tyktarmen eller lungerne.[7] Det er usædvanligt at se den sprede sig til knoglerne eller hjernen.[29]
Kræft i bugspytkirtlen kan omvendt også selv være en sekundær kræft, som har spredt sig fra andre dele af kroppen. Dette er usædvanligt og står kun for omkring 2% af alle tilfælde af bugspytkirtelkræft. Nyrekræft er i langt de fleste af disse tilfælde den kræftform, der spreder sig til bugspytkirtlen, fulgt af kolorektal kræft, og herefter hud-, bryst- og lungekræft. I disse tilfælde kan der foretages kirurgiske indgreb på bugspytkirtlen, hvad end det gøres i håb om en helbredelse eller for at lindre symptomer.[30]
Risikofaktorer
[redigér | rediger kildetekst]Blandt kendte risikofaktorer for pankreatisk adenokarcinom:[3][5][6][31]
- Alder og køn; risikoen for at udvikle bugspytkirtelkræft vokser med alderen. De fleste tilfælde sker efter det 65. år,[3] mens tilfælde før 40 år er usædvanlige. Sygdommen er en smule mere udbredt hos mænd end hos kvinder.[3]
- Cigaretter er den bedst-etablerede undgåelige risikofaktor for bugspytkirtelkræft, og risikoen næsten fordobles blandt langtidsrygere, hvor den både øges med antallet af røgede cigeretter og antallet af år som ryger. Risikoen falder langsomt efter rygestop og tager herefter omtrent 20 år, før den næsten er tilbage på niveau med ikke-rygere.[32]
- Fedme; en BMI på mere end 35 øger den relative risiko med omkring en halv.[6]
- Familiehistorie; 5–10% af alle tilfælde af bugspytkirtelkræft har en arvet komponent, hvor personens familie har historie med bugspytkirtelkræft.[5][33] Risikoen vokser stort hves mere end et blodsbeslægtet familiemedlem havde sygdommen, og mere moderat hvis de udviklede den før 50-års-alderen.[8] De fleste af de involverede gener er ikke blevet identificeret.[5][34] Arvelig bugspytkirtelbetændelse giver en stærkt øget livstidsrisiko for bugspytkirtelkræft på op til 30–40% ved 70-års-alderen.[7] Screening for tidlig bugspytkirtelkræft kan tilbydes individer med arvelig bugspytkirtelbetændelse på forskningsbasis.[35] Nogle mennesker kan sågar vælge at få deres bugspytkirtel kirurgisk fjernet for at forhindre eventuel fremtidig kræft.[7]
- Bugspytkirtelkræft er blevet forbundet med de følgende andre sjældne arvelige syndromer: Peutz–Jeghers-syndrom på grund af mutationer i STK11-tumorsuppressorgenet (meget sjælden, men en meget stærk risikofaktor); dysplastisk nævussyndrom (eller FAMMM-syndrom) på grund af mutationer i CDKN2A-tumorsuppressorgenet; autosomal recessiv Louis-Bar-syndrom og autosomale dominante nedarvede mutationer i BRCA2-genet og PALB2-genet; arvelig nonpolypøs tyk- og endetarmskræft (Lynch-syndrom); og familiær adenomatøs polypose. PanNET'er er blevet forbundet med Wermer's syndrom og von Hippel-Lindau-syndrom.[5][7][8]
- Kronisk bugspytkirtelbetændelse lader til næsten at tredoble risikoen, og ligesom det er tilfældet med diabetes, kan nyligt opstået bugspytkirtelbetændelse være et symptom på en tumor.[7] Risikoen for bugspytkirtelkræft hos personer med arvelig bugspytkirtelkræft er særligt høj.[7][34]
- Diabetes mellitus er en risikofaktor for bugspytkirtelkræft. Mennesker, som har været diagnosticeret med Diabetes mellitus type 2 i mere end ti år, kan have en 50% øget risiko sammenlignet med ikke-diabetikere.[7]
- Specifikke typer mad (set adskilt fra fedme) har ikke vist nogle klare tegn på at øge risikoen for bugspytkirtelkræft.[5] Blandt de kostelementer, som der er en vis evidens for at være forbundet med lettere øget risiko, er forarbejdet kød, rødt kød samt kød der tilberedes ved meget høje temperaturer (f.eks. ved stegning, bagning eller grillning).[36][37]
Alkohol
[redigér | rediger kildetekst]Et stort alkoholforbrug er en stor årsag til kronisk bugspytkirtelbetændelse, som til gengæld øger risikoen for bugspytkirtelkræft. En anseelig mængde forskning har ikke været i stand til endegyldigt at etablere alkoholindtag som en direkte risikofaktor for bugspytkirtelkræft. Samlet set er associationen svag, og størstedelen af studier har slet ikke fundet nogen forbindelse, med rygning som en stærk confounder. Der er stærkere evidens for en forbindelse til vedvarende druk med mindst seks genstande om dagen.[7][38]
Diagnose
[redigér | rediger kildetekst]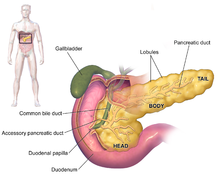
Symptomerne på pankreatisk adenokarcinom fremkommer normalt ikke i sygdommens tidlige stadier og er ikke individuelt unikt forbundet til sygdommen.[6][7][26] Symptomerne ved diagnosen kan variere alt efter, hvor i bugspytkirtlen kræften er opstået.
Uanset en tumors placering er det mest almindelige symptom uforklarligt, ofte stort, vægttab. En stor minoritet (mellem 35% og 47%) af alle mennesker, der får diagnosen, vil have oplevet kvalme, opkast eller en svaghedsfornemmelse. Tumorer i bugspytkirtelhovedet giver typisk også gulsot, smerte, mindsket appetit, mørk urin og lyst farvet afføring. Tumorer i kroppen og halen forårsager normalt også smerte.[26]
Nogle mennesker har for nylig fået konstateret atypisk type 2-diabetes, som er svær at kontrollere, har haft nylig, uforklarlig betændelse i blodkar forårsaget af blodpropper(tromboflebitis) kendt som Trousseau's syndrom eller et tidligere anfald af bugspytkirtelbetændelse.[26] En læge kan få mistanke om bugspytkirtelkræft, når diabetes, der rammer en person på over 50 år, følges af typiske symptomer såsom uforklarligt vægttab, vedvarende mave- eller rygsmerter, fordøjelsesproblemer, opkast eller fedtet afføring.[6] Gulsot ledsaget af en smerteløst opsvulmet galdeblære (kendt som Courvoisier-syndrom) kan også rejse mistanke og kan hjælpe med at differentiere bugspytkirtelkræft fra galdesten.[39]
Billeddiagnostikteknikker, såsom CT-scanning og endoskopisk ultralyd, anvendes begge til at bekræfte diagnosen og hjælpe med at afgøre, hvorvidt tumoren kan fjernes kirurgisk.[6] MR- og PET-scanning kan også anvendes,[5] og MRCP-scanning kan somme tider være nyttigt.[26] Abdominal ultralyd er mindre følsomt og kan overse små tumorer, men kan omvendt identificere kræft, der har spredt sig til leveren samt ophobning af væske i bughulen (ascites).[6] Det kan derfor anvendes som en hurtig og billig første undersøgelse, før andre teknikker tages i brug.[40]
En biopsi via finnålsaspiration, ofte vejledt af endoskopisk ultralyd, kan anvendes i tilfælde, hvor der er usikkerhed om diagnosen, men en histologisk diagnose kræves normalt ikke før, at en kirurgisk fjernelse af tumoren kan starte.[6]
Leverfunktionsprøver kan vise en kombination af resultater, der kan indikere en spærring af galdegangen (hævede niveauer af konjugeret bilirubin, γ-glutamyltransferase og alkalisk fosfatase). CA19-9 (carbohydratantigen 19.9) er en tumormarkør, der ofte hæves ved bugspytkirtelkræft - den mangler dog sensitivitet og specificitet, ikke mindst fordi 5% af alle mennesker mangler Lewis (a)-antigenet og slet ikke kan producere CA19-9. At anvende CA19-9 som tumormarkør har en sensitivitet på 80% og specificitet på 73% ved opdagelse af pankreatisk adenokarcinom, og anvendes til at følge kendte tilfælde snarere end til at stille diagnose.[5][6]
Den mest almindelige form for bugspytkirtelkræft (adenokarcinom) er typisk karakteriseret ved moderate til dårligt differentierede kirtelstrukturer ved mikroskopisk undersøgelse. Der er normalt anseelig desmoplasi eller dannelse af et tæt, fibrøst stroma eller strukturelt væv bestående af en række celletyper (heriblandt myofibroblaster, makrofager, lymfocytter og mastceller) og aflejret materiale (såsom type I-kollagen og hyaluronsyre). Dette skaber et tumormikromiljø, der mangler blodkar (hypovaskulært) og dermed også mangler ilt (tumorhypoxi).[5] Det menes, at dette forhindrer mange stoffer, der anvendes ved kemoterapi, i at nå tumoren, hvilket er med til at gøre det til en svær kræftform at behandle.[5][7]
Stadier
[redigér | rediger kildetekst]Eksokrine kræftformer
[redigér | rediger kildetekst]Bugspytkirtelkræfts stadie afgøres normalt efter en CT-scanning.[26] Det mest udbredte system af kræftstadier formuleres af American Joint Committee on Cancer (AJCC) i samarbejde med Union for International Cancer Control (UICC). The AJCC-UICC-stadiesystemet betegner fire overordnede stadier, fra tidlig til fremskreden sygdom, baseret på TNM-klassifikationen af Tumorstørrelse, spredning af lymfeknuder (eng. lymph Nodes),og Metastase.[41]
For at hjælpe behandlingen opdeles tumorerne herudover i tre bredere kategorier afhængig af, hvorvidt det lader til at være muligt at fjerne dem kirurgisk: om tumorer er "resekterbare", "på grænsen til resekterbare", eller "ikke-resekterbare".[42] Mens sygdommen stadig er i et tidligt stadie (AJCC-UICC-stadie I og II), uden spredning til større blodkar eller fjerne organer såsom leveren eller lungerne, kan man normalt udføre kirurgisk resektion af tumoren, hvis patienten er villig til at gennemgå denne større operation og vurderes at være helbredsmæssigt i stand til det.[6] AJCC-UICC-stadiesystemet tillader forskel mellem stadie III-tumorer, der vurderes at være "på grænsen til resekterbare" (hvor kirurgi er teknisk muligt, da truncus coeliacus og den øvre mesenteriske arterie stadig er frie) og de, der er "ikke-resekterbare" (på grund af mere lokale fremskreden sygdom); i forhold til den mere detaljerede TNM-klassifikation svarer disse to grupper til hhv. T3 og T4.[7]
- Stadier af bugspytkirtelkræft (TNM-klassifikation)
-
Stadie T1-bugspytkirtelkræft
-
Stadie T2-bugspytkirtelkræft
-
Stadie T3-bugspytkirtelkræft
-
Stadie T4-bugspytkirtelkræft
-
Bugspytkirtelkræft i nærliggende lymfeknuder – Stadie N1
-
Metastaseret bugspytkirtelkræft – Stadie M1
PanNET'er
[redigér | rediger kildetekst]WHO-klassifikationen af tumorer i fordøjelsessystemet (2010) graderer alle de pankreatiske neuroendokrine tumorer (PanNET'er) i tre kategorier, baseret på deres grad af cellulær differentiering (fra "NET G1" og frem til den dårligt differentierede "NET G3").[17] Det amerikanske National Comprehensive Cancer Network anbefaler brugen af det samme AJCC-UICC-stadiesystem som anvendes til pankreatisk adenokarcinom.[43] Ved brug af dette system er stadie-til-stadie-resultaterne for PanNET'er anderledes, end det er tilfældet for andre eksokrine kræftformer.[44] Et andet system er blevet foreslået af European Neuroendocrine Tumor Society.[17]
Forstadier
[redigér | rediger kildetekst]
Eksokrine kræftformer
[redigér | rediger kildetekst]
Disse kræftformer menes at opstå fra flere typer førkræft-læsioner i bugspytkirtlen. Disse læsioner udvikler sig ikke altid til kræft, og det store antal, der opdages som et biprodukt af øget brug af CT-scanning i andre sammenhænge, bliver ikke alle behandlet.[7] Bortset fra pankreatiske serøse cystadenomer (SCN'er), som næsten altid er benigne, kan der genkendes tre typer førkræft-læsioner.
Den første er pankreatisk intraepitelial neoplasier. Disse er mikroskopiske abnormiteter i bugspytkirtlen, som ofte findes ved obduktion af mennesker uden kræftdiagnoser. Disse kan udvikle sig fra lav til høj grad og efterfølgende til en tumor. Mere end 90% af alle tilfælde, ved alle grader, bærer et defekt KRAS-gen, mens der ved grad 2 og 3 ofte ses skade på yderligere tre gener – CDKN2A (p16), p53 og SMAD4.[5]
Den anden er intraduktal papillær mucinøs neoplasier (IPMN'er). Disse er makroskopiske læsioner, som rammer omkring 2% af alle voksne, voksende til omkring 10% ved 70-års-alderen, og har omkring 25% risiko for at udvikle sig til invasiv kræft. De har også meget ofte KRAS-genmutationer, i omkring 40–65% af alle tilfælde, samt mutationer i Gs alfa-underenheden GNAS samt RNF43, hvilket påvirker Wnt-signalvejen.[5] Selv hvis de fjernes kirurgisk, er der fortsat en anseelig risiko for efterfølgende at udvikle bugspytkirtelkræft.[7]
Den sidste type, pankreatiske mucinøse cystiske neoplasier (MCN'er), rammer hovedsageligt kvinder og kan enten forblive benigne eller udvikle sig til kræft.[45] Hvis de vokser, forårsager symptomer eller har andre mistænkelige egenskaber, kan de normalt fjernes kirurgisk.[7]
De genetiske begivenheder ved duktal adenokarcinom er blevet omfattende beskrevet, og der er fuldført exomsekventeringer for de almindelige tumortyper. Der er fundet fire muterede gener ved størstedelen af alle adenokarcinomer: KRAS (i 95% af tilfælde), CDKN2A (også i 95%), TP53 (75%) og SMAD4 (55%). Sidstnævnte er især forbundet med en dårlig prognose.[7] SWI/SNF-mutationer/deletioner forekommer i omkring 10–15% af adenokarcinomer.[5] Der er herudover blevet forsket i de genetiske forandringer i flere andre typer bugspytkirtelkræft og førkræft-læsioner.[7]
PanNET'er
[redigér | rediger kildetekst]De gener, der ofte muterer i PanNET'er, er nogle andre end det er tilfældet ved pankreatisk adenokarcinom.[46] For eksempel mangler KRAS-mutationen normalt, og i stedet fører arvelige MEN1-genmutationer til MEN1-syndrom, hvori primære tumorer opstår på to eller flere endokrine kirtler. Omkring 40–70% af alle mennesker, der fødes med en MEN1-mutation, vil med tiden udvikle en PanNET.[47] Blandt andre gener, der ofte muterer, er DAXX, mTOR og ATRX.[24]
Forebyggelse og screening
[redigér | rediger kildetekst]Bortset fra ikke at ryge anbefaler American Cancer Society også, at man holder en sund vægt, samt øger sit indtag af frugter, grøntsager og fuldkorn, samt spiser mindre rødt og forarbejdet kød, omend der ikke findes fast evidens for, at dette kan forhindre eller reducere bugspytkirtelkræft specifikt.[48] En gennemgang af eksisterende forskning konkluderede i 2014, at der var beviser for, at indtagelse af citrusfrugter og gurkemeje reducerer risikoen for bugspytkirtelkræft, mens der muligvis også er gavnlig effekt fra fuldkorn, folat, selen og ikke-stegt fisk.[38]
Screening af store grupper af den generelle befolkning betragtes i øjeblikket ikke som en effektiv tilgang, omend effektiviteten af nyere teknikker og screening af snævrere målgrupper fortsat evalueres.[49][50] På trods af dette anbefales fast screening med endoskopisk ultralyd samt MRI/CT-scanning til mennesker, der har forhøjet risiko på grund af nedarvet genetik.[8][40][50][51]
Håndtering
[redigér | rediger kildetekst]Eksokrine kræftformer
[redigér | rediger kildetekst]En central vurdering, der foretages efter diagnosen stilles, er hvorvidt, det er muligt at fjerne tumoren kirurgisk, da dette er den eneste kendte helbredelse af bugspytkirtelkræft.
Kemoterapi og, i mindre grad, radioterapi tilbydes til mange personer, uanset om kirurgi er muligt eller ej. Specialister anbefaler, at håndteringen af bugspytkirtelkræft bør tilfalde et multidisciplinært hold med specialister indenfor flere aspekter af onkologi, og behandlingen foretages derfor bedst på større hospitaler eller sundhedsklinikker.[5][7]
Kirurgi
[redigér | rediger kildetekst]
Om der kan tilbydes kirurgisk resektion eller ej, afhænger af hvor langt kræften har spredt sig, ligesom det også spiller ind hvor tumoren præcis befinder sig.[5] CT-scanning kan vise, hvordan den befinder sig i forhold til de store blodkar, der passerer tæt ved bugspytkirtlen. En tredje faktor, der spiller ind, er den pågældende persons overordnede helbred, omend alder ikke i sig selv er en forhindring for kirurgi,[7] samt hvor god muligheden er for at personen kan komme sig ovenpå operationen.[52][53]
Kirurgi med intention om at helbrede kræften er, på grund af den ofte meget sene diagnosticering, kun muligt i omkring 20% af alle nye tilfælde.[6] Selvom CT-scanninger hjælper, kan det i praksis være svært at afgøre, hvorvidt tumoren kan fjernes helt (dens "resekterbarhed"), og det kan somme tider først vise sig ved selve den kirurgiske operation, at det ikke er muligt at fjerne tumoren, uden samtidig at beskadige andet livsvigtigt væv.
Ved vurdering af resekterbarhed fokuseres der blandt andet på, om der findes et klart lag af fedt, der, ideelt set, danner en barriere mellem tumoren og de nærliggende blodkar.[7] Traditionelt foretages vurderingen af tumorens nærhed til større venøse eller arterielle kar i "abutment" (når tumoren højst berører halvdelen af et blodkars omkreds uden noget separerende fedt), "indkapsling" (når tumoren indkapsler størstedelen af karrets omkreds) eller fuld involvering af blodkarret .[54] En resektion, der omfatter indkapslede sektioner af blodkar, kan i nogle tilfælde være mulig,[55][56] især hvis det har vist sig muligt at have indledende neoadjuvant behandling[57][58][59] ved hjælp af kemoterapi[53][54][60] og/eller radioterapi.[54]
Selv når operationen lader til at have været vellykket, findes der ofte kræftceller omkring det fjernede vævs kanter ("marginer"), som, når en patolog undersøger dem mikroskopisk, kan indikere, at kræften ikke er blevet fuldstændig fjernet.[5] Ydermere er kræftstamceller normalt ikke tydelige mikroskopisk, og hvis de er til stede kan de fortsat udvikle sig og spredes.[61][62] En sonderende kikkertundersøgelse kan derfor efterfølgende være nødvendig for at få en tydeligere idé om en udført operations overordnede resultat.[63][skal opdateres]
Hvad angår kræft i bugspytkirtlens hoved, anvendes oftest en Whipple-procedure. Dette er en større operation, hvor bugspytkirtlens hoved, samt tolvfingertarmens kurve fjernes samtidigt, og der foretages en bypass for mad fra mavesækken og til hungertarmen, samt tilføjes et loop af hungertarmen til galdeblæregangen for at dræne galde. Denne procedure kan kun udføres, hvis personen vurderes i stand til at overleve en større operation, samt at kræften er lokal uden metastase eller invasive lokale strukturer - proceduren udføres derfor kun i et fåtal af tilfælde. Kræft i bugspytkirtlens hale kan resekteres ved hjælp af en procedure, der kendes som distal pankreatektomi , som også ofte omfatter fjernelse af milten.[5][7] Dette kan nu gøres med en minimalt invasiv kirurgisk operation.[5][7]
Selvom kurativ kirurgi ikke længere er forbundet med den meget store dødelighedsprocent, som det var tilfældet op til 1980'erne, skal en stor andel af mennesker (omkring 30–45%) dog stadig behandles for en post-operationssygdom, der ikke forårsages af selve kræften. Den mest almindelige komplikation fra kirurgi er problemer med at tømme maven.[7]
I palliativ behandlingssammenhæng anvendes visse mere begrænsede kirurgiske procedurer til at lette kræftsymptomer. For eksempel hvis kræften invaderer eller presser tolvfingertarmen eller tyktarmen. I sådanne tilfælde kan en bypassoperation omgå spærringen og forbedre livskvalitet, omend det ikke er en helbredelse.[6]
Kemoterapi
[redigér | rediger kildetekst]Efter kirurgi, samt en hvileperiode på 1-2 måneder, kan adjuverende kemoterapi med gemcitabin eller 5-FU tilbydes, hvis personens helbred er tilpas godt.[8][40] Hos mennesker, der ikke er friske nok til kurativ kirurgi, kan kemoterapi anvendes til at forlænge livet eller livskvaliteten.[7] Før kirurgi kan der anvendes neoadjuverende kemoterapi eller kemoradioterapi i de tilfælde, der vurderes at være på grænsen til resekterbare, for at reducere kræften til et niveau, hvor kirurgi kan være gavnligt. I andre tilfælde er anvendelsen af neoadjuverende behandling fortsat kontroversiel, da den forsinker det kirurgiske indgreb.[7][8][64]
Såkaldt FOLFIRINOX-kemiterapeutisk behandling med fire typer medicin er blevet vurderet mere effektivt end behandling med gemcitabin, men har dog alvorlige bivirkninger, og bør derfor kun anvendes på personer med et overordnet godt helbred. Det samme gør sig gældende med proteinbundet paclitaxel (nab-paclitaxel), der evt. kan bruges sammen med gemcitabin ved behandling af bugspytkirtelkræft.[65][66] Både FOLFIRINOX og nab-paclitaxel med gemcitabin vurderes som gode valg til personer, der kan tolerere bivirkningerne, og gemcitabin alene er fortsat en effektiv mulighed for de, der ikke kan.
Radioterapi
[redigér | rediger kildetekst]Radioterapis rolle som en understøttende (adjuverende) behandlingsform efter potentielt kurativ kirurgi har været kontroversiel siden 1980'erne.[7] European Society for Medical Oncology anbefaler, at adjuverende radioterapi kun bør bruges på personer, der er en del af kliniske forsøg.[40] Der er dog en fortsat tendens til, at behandlere i USA er mere tilbøjelige til at anvende adjuverende radioterapi end deres europæiske kollegaer. Der er blevet udført mange kliniske forsøg på en række forskellige behandlingskombinationer siden 1980'erne, men disse har endnu ikke endegyldigt kunnet konkludere noget i sammenhængen.[7][8]
Radioterapi kan udgøre en del af behandling til at forsøge at skrumpe en tumor ned til et resekterbart stadie, men dens brug på ikke-resekterbare tumorer er kontroversiel, da der er modstridende resultater fra kliniske forsøg. De foreløbige resultater fra et forsøg, præsenteret i 2013, reducerede mærkbart entusiasmen for brug af radioterapi mod lokalt fremskredne tumorer.[5]
PanNET'er
[redigér | rediger kildetekst]Behandling af PanNET'er, heriblandt de mindre udbredte maligne former, kan omfatte flere forskellige tilgange.[43][67][68][69] Nogle små tumorer på mindre end 1 cm., som eksempelvis kan opdages ved et tilfælde under en CT-scanning med et andet formål, kan følges op af af watchful waiting.[43] Dette afhænger af den vurderede risiko ved kirurgisk indgreb, som igen påvirkes af tumorens placering samt tilstedeværelsen af andre problemer.[43] Tumorer, der kun er indenfor bugspytkirtlen, eller med meget begrænset metastase, for eksempel til leveren, kan fjernes ved kirurgi. Typen af kirurgisk indgreb afhænger af tumorens placering og i hvor høj grad kræften har spredt sig til lymfeknuderne.[17]
Hvis tumoren er lokal kan den kirurgiske procedure nøjes med at være langt mindre end de typer kirurgi, der anvendes mod pankreatisk adenokarcinom, men ellers er de kirurgiske procedurer nogenlunde de samme som for eksokrine tumorer. Rækken af mulige udfald varierer voldsomt; nogle typer har en meget høj overlevelsesrate efter indgreb, mens andre har dårligere odds. Da alle typer tumorer i denne gruppe er sjældne, understreger de fleste retningslinjer behovet for at behandlingen finder sted i et specialiseret center.[17][24] Brug af levertransplantation kan overvejes i visse tilfælde af levermetastase.[70]
For fungerende tumorer kan den somatostatin-analoge klasse af medikamenter, såsom octreotid, reducere den øgede hormonproduktion.[17] Lanreotid kan sløve tumorvækst.[71] Hvis tumoren ikke egner sig til kirurgisk fjernelse og forårsager symptomer, kan målrettet behandling med everolimus eller sunitinib reducere symptomerne og sløve sygdommens progression.[72][24][73][74] Almindelig cytotoksisk kemoterapi er generelt ikke videre effektiv overfor PanNET'er, men kan anvendes når andre lægemidler ikke er i stand til at forhindre sygdommens forløb,[24][75] eller i tilfælde af dårligt differentierede PanNET-kræftformer.[76]
Radioterapi anvendes til tider hvis der er smerter på grund af anatomisk ekstension såsom metastase til knogler. Nogle PanNET'er absorberer specifikke peptider eller hormoner, og disse PanNET'er kan respondere på nuklearmedicinsk behandling med radioaktivt mærkede peptider eller hormoner såsom iobenguan (iodine-131-MIBG).[77][78][79][80] Radiofrekvensablation (RFA), kryoablation og hepatisk arterieembolisering kan ligeledes anvendes.[81][82]
Palliativ behandling
[redigér | rediger kildetekst]Palliativ behandling er medicinsk behandling, der fokuserer på at behandle symptomerne på alvorlige sygdomme, såsom kræft, snarere end selve sygdommen, i håb om at forbedre personens livskvalitet.[83] Da pankreatisk adenokarcinom normalt først diagnosticeres efter den har udviklet sig til et fremskredent stadie, er palliativ behandling af symptomerne ofte den eneste mulige behandling.[84]
Palliativ behandling fokuserer på at behandle eksempelvis smerte eller kvalme og kan assistere beslutningstagen omkring, eksempelvis, om eller hvornår hospicepleje vil være gavnligt.[85] Smerte kan holdes under kontrol med medikamenter såsom opioider eller gennem proceduremæssig indgriben ved en nerveblokade på solar plexus (også kaldet en Plexus coeliacus-blokade, ofte forkortet "CPB" fra det engelske term, celiac plexus blockade). Dette ændrer eller, afhængig af den anvendte teknik, ødelægger de nerver, der transmitterer smerte fra maven. En CPB er en sikker og effektiv måde at reducere smerten, hvilket generelt reducerer behovet for smertestillende opioider, der kan have alvorlige negative bivirkninger.[7][86]
Blandt andre symptomer eller komplikationer, der kan behandles med palliativ kirurgi, er tumorens obstruktion af tarmene eller galdegangene. I sidstnævnte tilfælde, som opstår i godt over halvdelen af alle tilfælde, kan et kort metalrør, en stent, indsættes via endoskop for at sikre, at gangene drænes.[26] Palliativ behandling kan også hjælpe med at behandle depression, som mange rammes af efter at blive diagnosticeret med bugspytkirtelkræft.[7]
Både kirurgi og fremskredne inoperable tumorer fører ofte til uorden i fordøjelsessystemet på grund af en mangel på bugspytkirtlens eksokrine produkter (eksokrin pancreasinsufficiens[87]). Disse problemer kan behandles ved at tage pankreatin, som indeholder fremstillede pankreatiske enzymer, og helst bør indtages sammen med mad.[6] Problemer med at tømme maven (forsinket ventrikeltømning eller gastroparese) er udbredt og kan være et alvorligt problem, der somme tider kræver indlæggelse. Behandlingen herimod kan involvere flere tilgange, heriblandt at dræne maven via nasogastrisk aspiration og medicin kaldet protonpumpehæmmere eller H2-receptorantagonister, som begge reducerer produktionen af mavesyre.[6]
Prognose
[redigér | rediger kildetekst]| Overlevelse (%) – Danmark, diagnoser 2010-2014[88] | ||
|---|---|---|
| Mænd | Kvinder | |
| Efter 1 år | 27 | 31 |
| Efter 5 år | 7 | 8 |
Pankreatisk adenokarcinom og andre mindre udbredte eksokrine kræftformer har en meget dårlig prognose, da de normalt først diagnosticeres i et meget sent stadie, hvor kræften allerede er lokalt fremskreden eller har spredt sig til andre dele af kroppen.[5] Prognosen er væsentligt bedre for PanNET'er: mange er benigne og helt uden kliniske symptomer, og selv de tilfælde, der ikke kan behandles med kirurgi, har en femårs-overlevelsesrate på 16%,[42] omend prognosen varierer betragteligt afhængigt af kræftform.[25]
Hvad angår lokalt fremskredne samt metastatiske pankreatiske adenokarcinomer, som tilsammen repræsenterer over 80% af alle tilfælde, har flere nylige forsøg med sammenligning af kemoterapiformer vist en øget overlevelsestid, men ikke med mere end et år.[5][89]
Udbredelse
[redigér | rediger kildetekst]
Pr. 2012 resulterede bugspytkirtelkræft årligt i 330.000 dødsfald på verdensplan,[3] hvilket var en stigning fra 310.000 i 2010 og 200.000 i 1990.[90] Det er den syvende-højeste årsag til kræftrelaterede dødsfald på verdensplan.[3]
PanNET'er
[redigér | rediger kildetekst]Klinisk anerkendte PanNET'ers årlige incidens er lav (omkring 5 pr. en million personår) og domineres af de ikke-fungerende former[21] - det menes, at et sted mellem 45% og 90% af alle PanNET'er er ikke-fungerende former.[17][24] Studier af obduktioner har fundet mindre PanNET'er relativt ofte, hvilket tyder på en høj prævalens af tumorer, der forbliver inaktive og asymptomatiske.[24] Samlet set menes PanNET'er at repræsentere omkring 1-2% af alle tilfælde af bugspytkirtelkræft.[21] PanNET'ers definition og klassificering har dog ændret sig med tiden, hvilket påvirker den registrerede viden om deres epidemiologi og kliniske relevans.[46]
Historie
[redigér | rediger kildetekst]Den tidligste opdagelse af bugspytkirtelkræft tilskrives den italienske videnskabsmand Giovanni Battista Morgagni (1682-1771), den moderne anatomiske patologis historiske far, som mente at have sporet flere tilfælde af kræft i bugspytkirtlen. Mange læger var i det 18. og 19. århundrede skeptiske omkring sygdommens eksistens, givet dens tilsyneladende ens udseende med bugspytkirtelbetændelse. Der blev udgivet kasuistikker i 1820'erne og 1830'erne, og senere lavede den amerikanske kliniker Jacob Mendes Da Costa, der selv betvivlede Morgagnis fortolkningers pålidelighed, en egentlig histopatologisk diagnose. Ved starten på det 20. århundrede var kræft i bugspytkirtelhovedet blevet en veletableret diagnose.[91]
Muligheden for kræft i ø-cellerne blev oprindeligt foreslået i 1888. Det første tilfælde af hyperinsulinisme som følge af denne tumorform blev rapporteret i 1927. Anerkendelse af en ikke-insulin-udskillende form for PanNET tilskrives normalt de amerikanske kirurger R. M. Zollinger og E. H. Ellison, som lagde navn til Zollinger–Ellison-syndrom, efter de postulerede eksistensen af en gastrin-udskillende pankreatisk tumor, i en rapport udgivet i 1955, om to tilfælde af usædvanligt voldsomme mavesår.[91] I 2010 anbefalede WHO, at PanNET'er blev omtalt som "neuroendokrine" snarere end "endokrine" tumorer.[23]
Den første rapporterede delvise operation ved det, der senere blev kendt som Whipple-proceduren, (pankreatikoduodenektomi ) blev udført af den italienske kirurg Alessandro Codivilla i 1898, men patienten overlevede kun i 18 dage, før han døde pga. komplikationer. Tidlige operationer blev kompromitteret delvist på grund af en fejlagtig tro på, at man ville dø, hvis man fik fjernet sin tolvfingertarm, eller hvis strømmen af bugspyt blev stoppet. Senere mente man, også fejlagtigt, at bugspytkirtelgangen blot kunne bindes sammen uden alvorlige følger (den vil meget ofte senere begynde at lække). I 1907–08 begyndte nogle franske kirurger at foretage eksperimentelle operationer på lig.[92]
I 1912 var den tyske kirurg Walther Kausch den første til at fjerne store dele af tolvfingertarmen og bugspytkirtlen på en gang (en bloc). I 1918 blev det ved operationer på hunde demonstreret, at den fuldstændige fjernelse af tolvfingertarmen var kompatibel med fortsat liv, men dette blev ikke rapporteret ved kirurgi på mennesker før 1935, da den amerikanske kirurg Allen Oldfather Whipple udgav resultaterne af tre operationer på Columbia Presbyterian Hospital i New York. Kun en af patienterne fik tolvfingertarmen fuldstændigt fjernet, men han overlevede i to år, før han døde pga. metastase til leveren. Den første operation var ikke planlagt, da kræften først blev opdaget på operationsbordet. Whipples vellykkede operation førte til udbredelsen af det, der blev kendt som en Whipple-procedure. Whipple offentliggjorde efterfølgende flere forbedringer til sin procedure, heriblandt den første fuldstændige fjernelse af tolvfingertarmen i 1940. I alt udførte han dog kun 37 operationer.[92] Opdagelsen i de sene 1930'ere af, at vitamin K forhindrede blødning med gulsot, samt udviklingen af blodtransfusion som en hverdagsproces, sænkede begge risici associeret med operation,[92] men helt frem til 1970'erne døde op til 25% af patienterne på operationsbordet.[93] I 1970'erne skrev en gruppe amerikanske kirurger, at proceduren var for farlig og burde droppes. Siden da er udfaldene på større centre dog blevet væsentligt forbedrede, og dødeligheden er nu ofte mindre end 4%.[19] I 2006 blev der udgivet en rapport med en række på over 1000 Whipple-procedurer i træk udført af en enkelt kirurg fra Johns Hopkins Hospital i perioden mellem 1969 og 2003. Disse operationers frekvens var steget støt i perioden, og kun tre af dem lå før 1980, mens median-operationstiden var blevet reduceret fra 8,8 timer i 1970'erne til 5,5 timer i 2000'erne, og dødelighed indenfor 30 dage eller på hospitalet var på kun 1%.[92][93] En anden række af 2050 operationer på Massachusetts General Hospital mellem 1941 og 2011 viste et lignende mønster af gradvise forbedringer.[94]
Med moderne billedteknikker opdages små førkræft-neoplasier for mange bugspytkirtelkræfttilfælde nu i langt højere grad end tidligere. En type, de intraduktale papillære mucinøse neoplasier (IPMN), blev for første gang beskrevet af japanske forskere i 1982.[95]
Forskning
[redigér | rediger kildetekst]Der er i øjeblikket flere verdensomspændende indsatser i gang for at forsøge at forstå bugspytkirtelkræft, men der gøres kun langsomt fremskridt - især i med at forstå sygdommens årsager.[96] Der er på dette punkt flere grundlæggende ubesvarede spørgsmål.[97][98] Der fokuseres intenst på de forandringer, der fører til sygdommen, heriblandt den rolle gener som KRAS og p53 spiller.[34][99][100] Et centralt spørgsmål er timingen af diverse hændelser efterhånden som sygdommen skrider frem – særligt diabetes' rolle,[101] samt hvordan og hvornår sygdommen spredes.[102]
Der forskes fortsat i tidlig opdagelse.[49][50] For eksempel udfører European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC) nogle forsøg for at afgøre, om regelmæssig screening er et passende tilbud til mennesker fra familier med sygdommen, eller som har arvelig bugspytkirtelbetændelse.[103] Visheden om at nyligt opstået diabetes kan være et tidligt tegn på sygdommen, kunne facilitere en rettidig diagnosticering og sekundær forebyggelse, hvis der kan udvikles en fungerende screeningsstrategi.[101][104][105]
Et andet interesseområde er at afgøre, om kikkertoperationer er at foretrække for Whipples procedure ved kirurgisk behandling af sygdommen, især hvad angår restitutionstid.[106] Irreversibel elektroporation (IRE) er en relativt ny ablationsteknik , der har vist sig lovende i forhold til downstaging og forlænget overlevelse hos personer med lokalt fremskreden bugspytkirtelkræft. IRE er især brugbart til behandling af tumorer, der ligger i nærheden af peripankreatiske blodkar uden risiko for vaskulære problemer.[107][108] Den begrænsede succes blandt udfald efter kirurgi har ført til en række forsøg, der blev sat i gang i 2014 for at teste udfald ved brug af kemoterapi eller radiokemoterapi før kirurgi. Dette blev tidligere ikke ment at være nyttigt, men testes igen, nu i kombination med lægemidler, som er kommet frem siden i forbindelse med de mange forsøg med post-operationsterapi, heriblandt FOLFIRINOX.[5]
Der er fortsat forsøg på at udvikle nye lægemidler.[34][109] Flere involverer målrettede behandlinger mod kræftcellernes molekylære mekanismer.[110][111][112] Andre forsøger at ramme de stærkt resistente kræftstamceller,[62][113] mens andre har som mål at ramme tumorens ikke-neoplasiske stromaceller og mikromiljø, der vides at påvirke cellevækst og metastase.[112][113][114][115][116] En yderligere tilgang omfatter brugen af immunterapi som onkolytiske vira.[117][118]
Henvisninger
[redigér | rediger kildetekst]- ^ https://www.sundhed.dk/sundhedsfaglig/laegehaandbogen/mave-tarm/tilstande-og-sygdomme/bugspytkirtel/pankreaskraeft/
- ^ "What is Cancer? Defining Cancer". National Cancer Institute, National Institutes of Health. 7. marts 2014. Hentet 5. december 2014.
- ^ a b c d e f g h i j k l World Cancer Report 2014. World Health Organization. 2014. Chapter 5.7. ISBN 92-832-0429-8.
- ^ a b c "Pancreatic Cancer Treatment (PDQ®) Patient Version". National Cancer Institute. National Institutes of Health. 17. april 2014. Hentet 8. juni 2014.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z æ ø å Ryan DP, Hong TS, Bardeesy N (september 2014). "Pancreatic adenocarcinoma" (PDF). N. Engl. J. Med. 371 (11): 1039-49. doi:10.1056/NEJMra1404198. PMID 25207767. Arkiveret fra originalen (PDF) 26. december 2014. Hentet 5. januar 2017.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Bond-Smith G, Banga N, Hammond TM, Imber CJ (2012). "Pancreatic adenocarcinoma" (PDF). BMJ (Clinical research ed.). 344: e2476. doi:10.1136/bmj.e2476. PMID 22592847. Arkiveret fra originalen (PDF) 9. januar 2015. Hentet 5. januar 2017.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z æ ø å aa ab ac Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH (september 2013). "Recent progress in pancreatic cancer". CA: A Cancer Journal for Clinicians. 63 (5): 318-48. doi:10.3322/caac.21190. PMC 3769458. PMID 23856911.
- ^ a b c d e f g h Vincent A, Herman J, Schulick R, Hruban RH, Goggins M (august 2011). "Pancreatic cancer" (PDF). Lancet. 378 (9791): 607-20. doi:10.1016/S0140-6736(10)62307-0. PMID 21620466. Arkiveret fra originalen (PDF) 12. januar 2015. Hentet 5. januar 2017.
- ^ Bussom S, Saif MW (5. marts 2010). "Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010". JOP : Journal of the pancreas. 11 (2): 128-30. PMID 20208319.
- ^ "Can pancreatic cancer be prevented?". American Cancer Society. 11. juni 2014. Arkiveret fra originalen 13. november 2014. Hentet 13. november 2014.
- ^ Shahrokni A, Saif MW (10. juli 2013). "Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life". JOP : Journal of the pancreas. 14 (4): 391-4. doi:10.6092/1590-8577/1663. PMID 23846935.
- ^ Bardou M, Le Ray I (december 2013). "Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies". Best practice & research. Clinical gastroenterology. 27 (6): 881-92. doi:10.1016/j.bpg.2013.09.006. PMID 24182608.
- ^ [1] og [2]
- ^ "Cancer Facts & Figures 2010" (PDF). American Cancer Society. 2010. Arkiveret fra originalen (PDF) 14. januar 2015. Hentet 5. december 2014. See p. 4 for incidence estimates, and p. 19 for survival percentages.
- ^ "Pancreatic Cancer Treatment (PDQ®) Health Professional Version". National Cancer Institute. National Institutes of Health. 21. februar 2014. Hentet 24. november 2014. "The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20% of cases. In cases with localized disease and small cancers (<2 cm) with no lymph node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is associated with an actuarial five-year survival rate of 18% to 24%."
- ^ Harris, RE (2013). "Epidemiology of pancreatic cancer". Epidemiology of Chronic Disease. Jones & Bartlett. s. 181-190. ISBN 978-0-7637-8047-0.
- ^ a b c d e f g Öberg K, Knigge U, Kwekkeboom D, Perren A (oktober 2012). "Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii124-30. doi:10.1093/annonc/mds295. PMID 22997445. (Table 5 outlines the proposed TNM staging system for PanNETs.)
- ^ Handbook of Pancreatic Cancer. New York: Springer. 2009. s. 288. ISBN 978-0-387-77497-8. Hentet 12. juni 2016.
- ^ a b Govindan R (2011). DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology (9th udgave). Lippincott Williams & Wilkins. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN 978-1-4511-0545-2. Online edition, with updates to 2014
- ^ a b c Tobias JS, Hochhauser D (2014). Cancer and its Management (7th udgave). s. 297. ISBN 978-1-118-46871-5.
- ^ a b c "Types of Pancreas Tumors". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Arkiveret fra originalen 8. oktober 2014. Hentet 18. november 2014.
- ^ Farrell JJ, Fernández-del Castillo C (juni 2013). "Pancreatic cystic neoplasms: management and unanswered questions". Gastroenterology. 144 (6): 1303-15. doi:10.1053/j.gastro.2013.01.073. PMID 23622140.
- ^ a b PanNET-betegnelsen er i overensstemmelse med WHO-retningslinjerne for klassificering af tumorer i fordøjelsessystemet [3] udgivet i 2010. Historisk er PanNET'er også blevet henvist til med flere andre begreber, og kaldes stadig ofte "pankreatiske endokrine tumorer". Se: Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S (august 2010). "The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems" (PDF). Pancreas. 39 (6): 707-12. doi:10.1097/MPA.0b013e3181ec124e. PMID 20664470. Arkiveret fra originalen (PDF) 24. september 2015. Hentet 5. januar 2017.
- ^ a b c d e f g Burns WR, Edil BH (marts 2012). "Neuroendocrine pancreatic tumors: guidelines for management and update". Current treatment options in oncology. 13 (1): 24-34. doi:10.1007/s11864-011-0172-2. PMID 22198808.
- ^ a b "Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas". The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012. Arkiveret fra originalen 5. januar 2015. Hentet 5. januar 2015.
- ^ a b c d e f g De La Cruz MS, Young AP, Ruffin MT (april 2014). "Diagnosis and management of pancreatic cancer". Am Fam Physician. 89 (8): 626-32. PMID 24784121.
- ^ a b Alberts, SR; Goldberg, RM (2009). "Chapter 9: Gastrointestinal tract cancers". I Casciato, DA; Territo, MC (red.). Manual of clinical oncology. Lippincott Williams & Wilkins. s. 188–236. ISBN 978-0-7817-6884-9.
- ^ Pannala R, Basu A, Petersen GM, Chari ST (januar 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". The Lancet. Oncology. 10 (1): 88-95. doi:10.1016/S1470-2045(08)70337-1. PMC 2795483. PMID 19111249.
- ^ "Chapter 15; Pancreas". Manual for Staging of Cancer (PDF) (2nd udgave). American Joint Committee on Cancer. s. 95-8. See page 95 for citation regarding "... lesser degree of involvement of bones and brain and other anatomical sites."
- ^ Sperti C, Moletta L, Patanè G (15. oktober 2014). "Metastatic tumors to the pancreas: The role of surgery". World Journal of Gastrointestinal Oncology. 6 (10): 381-92. doi:10.4251/wjgo.v6.i10.381. PMID 25320654.
- ^ "Causes of pancreatic cancer". NHS Choices. National Health Service, England. 7. oktober 2014. Hentet 5. december 2014.
- ^ Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji BT, Negri E, Li D, Risch HA, Olson SH, Gallinger S, Miller AB, Bueno-de-Mesquita HB, Talamini R, Polesel J, Ghadirian P, Baghurst PA, Zatonski W, Fontham E, Bamlet WR, Holly EA, Bertuccio P, Gao YT, Hassan M, Yu H, Kurtz RC, Cotterchio M, Su J, Maisonneuve P, Duell EJ, Boffetta P, La Vecchia C (juli 2012). "Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4)". Annals of Oncology. 23 (7): 1880-8. doi:10.1093/annonc/mdr541. PMID 22104574.
- ^ Peters, ML; Tseng, JF; Miksad, RA (31. marts 2016). "Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment". Clinical therapeutics. 38: 1622-35. doi:10.1016/j.clinthera.2016.03.006. PMID 27041411.
- ^ a b c d Reznik R, Hendifar AE, Tuli R (2014). "Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma". Front Physiol. 5: 87. doi:10.3389/fphys.2014.00087. PMC 3939680. PMID 24624093.
- ^ Greenhalf W, Grocock C, Harcus M, Neoptolemos J (2009). "Screening of high-risk families for pancreatic cancer". Pancreatology. 9 (3): 215-22. doi:10.1159/000210262. PMID 19349734.
- ^ "Cancer Facts and Figures 2014" (PDF). American Cancer Society. Arkiveret fra originalen (PDF) 18. december 2014. Hentet 5. januar 2015., p. 19, "Though evidence is still accumulating, consumption of red or processed meat, or meat cooked at very high temperatures, may slightly increase risk."
- ^ Larsson SC, Wolk A (januar 2012). "Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies". Br J Cancer. Online first (3): 603-7. doi:10.1038/bjc.2011.585. PMC 3273353. PMID 22240790.
- ^ a b Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME (januar 2014). "Nutrition and pancreatic cancer". Anticancer research. 34 (1): 9-21. PMID 24403441.
- ^ Fitzgerald JE, White MJ, Lobo DN (april 2009). "Courvoisier's gallbladder: law or sign?" (PDF). World Journal of Surgery. 33 (4): 886-91. doi:10.1007/s00268-008-9908-y. PMID 19190960. Arkiveret fra originalen den 5. januar 2015. Hentet 6. januar 2017.
{{cite journal}}: CS1-vedligeholdelse: BOT: original-url status ukendt (link) - ^ a b c d Seufferlein T, Bachet JB, Van Cutsem E, Rougier P (oktober 2012). "Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 23 Suppl 7: vii33-40. doi:10.1093/annonc/mds224. PMID 22997452.
- ^ Cascinu S, Falconi M, Valentini V, Jelic S (maj 2010). "Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 21 Suppl 5: v55-8. doi:10.1093/annonc/mdq165. PMID 20555103.
- ^ a b "Staging of pancreatic cancer". American Cancer Society. 11. juni 2014. Arkiveret fra originalen 10. august 2020. Hentet 29. september 2014.
- ^ a b c d "Neuroendocrine tumors, NCCN Guidelines Version 1.2015" (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 11. november 2014. Hentet 25. december 2014.
- ^ National Cancer Institute. Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®) Incidence and Mortality [4]
- ^ Delpu Y, Hanoun N, Lulka H, Sicard F, Selves J, Buscail L, Torrisani J, Cordelier P (2011). "Genetic and epigenetic alterations in pancreatic carcinogenesis". Curr Genomics. 12 (1): 15-24. doi:10.2174/138920211794520132. PMC 3129039. PMID 21886451.
- ^ a b Lewis MA, Yao JC (februar 2014). "Molecular pathology and genetics of gastrointestinal neuroendocrine tumours". Current Opinion in Endocrinology & Diabetes and Obesity. 21 (1): 22-7. doi:10.1097/MED.0000000000000033. PMID 24310147.
- ^ Thakker RV, Newey PJ, Walls GV, Bilezikian J, Dralle H, Ebeling PR, Melmed S, Sakurai A, Tonelli F, Brandi ML (september 2012). "Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1)" (PDF). The Journal of Clinical Endocrinology and Metabolism. 97 (9): 2990-3011. doi:10.1210/jc.2012-1230. PMID 22723327. Arkiveret fra originalen (PDF) 17. februar 2015. Hentet 6. januar 2017.
- ^ "Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section". American Cancer Society. 20. august 2012. Arkiveret fra originalen 4. november 2014. Hentet 4. november 2014.
- ^ a b He XY, Yuan YZ (august 2014). "Advances in pancreatic cancer research: moving towards early detection". World J. Gastroenterol. 20 (32): 11241-8. doi:10.3748/wjg.v20.i32.11241. PMC 4145762. PMID 25170208.
- ^ a b c Okano K, Suzuki Y (august 2014). "Strategies for early detection of resectable pancreatic cancer". World J. Gastroenterol. 20 (32): 11230-40. doi:10.3748/wjg.v20.i32.11230. PMC 4145761. PMID 25170207.
- ^ Stoita A, Penman ID, Williams DB (maj 2011). "Review of screening for pancreatic cancer in high risk individuals". World J. Gastroenterol. 17 (19): 2365-71. doi:10.3748/wjg.v17.i19.2365. PMC 3103788. PMID 21633635.
- ^ Gurusamy KS, Kumar S, Davidson BR, Fusai G (2014). "Cochrane Database of Systematic Reviews". The Cochrane database of systematic reviews. 2 (2): CD010244. doi:10.1002/14651858.CD010244.pub2. PMID 24578248.
- ^ a b Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J (2011). "Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis". Annals of Surgery. 254 (6): 882-93. doi:10.1097/SLA.0b013e31823ac299. PMID 22064622.
- ^ a b c "Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015" (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 4. december 2014. Hentet 26. december 2014.
- ^ Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, Gómez MA, Muntané J, Padillo FJ (2014). "Improving outcomes in pancreatic cancer: key points in perioperative management". World J. Gastroenterol. 20 (39): 14237-45. doi:10.3748/wjg.v20.i39.14237. PMC 4202352. PMID 25339810.
- ^ Lopez NE, Prendergast C, Lowy AM (2014). "Borderline resectable pancreatic cancer: definitions and management". World J. Gastroenterol. 20 (31): 10740-51. doi:10.3748/wjg.v20.i31.10740. PMC 4138454. PMID 25152577.
- ^ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M (2014). "Neoadjuvant strategies for pancreatic cancer". World J. Gastroenterol. 20 (28): 9374-83. doi:10.3748/wjg.v20.i28.9374 (inaktiv 2016-06-20). PMC 4110569. PMID 25071332.
{{cite journal}}: CS1-vedligeholdelse: DOI inaktiv siden juni 2016 (link) - ^ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J (2010). "Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages". PLoS Med. 7 (4): e1000267. doi:10.1371/journal.pmed.1000267. PMC 2857873. PMID 20422030.
- ^ Christians KK, Evans DB (2014). "Additional Support for Neoadjuvant Therapy in the Management of Pancreatic Cancer". Ann. Surg. Oncol. 22 (6): 1755-8. doi:10.1245/s10434-014-4307-0. PMID 25519932.
- ^ Tsvetkova EV, Asmis TR (2014). "Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?". Curr Oncol. 21 (4): e650-7. doi:10.3747/co.21.2006. PMC 4117630. PMID 25089113.
- ^ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY (2015). "Pancreatic cancer stem cells: New insight into a stubborn disease". Cancer Lett. 357 (2): 429-37. doi:10.1016/j.canlet.2014.12.004. PMID 25499079.
- ^ a b Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R (2014). "Cancer stem cells: Involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics". World Journal of Gastroenterology. 20 (31): 10790-801. doi:10.3748/wjg.v20.i31.10790. PMC 4138459. PMID 25152582.
- ^ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR (2013). "Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer". Cochrane Database Syst Rev. 11 (11): CD009323. doi:10.1002/14651858.CD009323.pub2. PMID 24272022.
- ^ Heinemann V, Haas M, Boeck S (oktober 2013). "Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer". Annals of Oncology. 24 (10): 2484-92. doi:10.1093/annonc/mdt239. PMID 23852311.
- ^ Uafgjort mellem to behandlinger af bugspytkirtelkræft
- ^ Borazanci E, Von Hoff DD; Von Hoff, DD (september 2014). "Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer". Expert Rev Gastroenterol Hepatol. 8 (7): 739-47. doi:10.1586/17474124.2014.925799. PMID 24882381.
- ^ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, Salazar R, Taal BG, Vullierme MP, O'Toole D (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors". Neuroendocrinology. 95 (2): 120-34. doi:10.1159/000335587. PMID 22261872.
- ^ Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R (2012). "ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes". Neuroendocrinology. 95 (2): 98-119. doi:10.1159/000335591. PMC 3701449. PMID 22261919.
- ^ Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R (2012). "ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary". Neuroendocrinology. 95 (2): 157-76. doi:10.1159/000335597. PMID 22262022.
- ^ Rossi RE, Massironi S, Conte D, Peracchi M (2014). "Therapy for metastatic pancreatic neuroendocrine tumors". Annals of Translational Medicine. 2 (1): 8. doi:10.3978/j.issn.2305-5839.2013.03.01 (inaktiv 2016-06-20). PMC 4200651. PMID 25332984.
{{cite journal}}: CS1-vedligeholdelse: DOI inaktiv siden juni 2016 (link) - ^ Nick Mulcahy (17. december 2014). "FDA Approves Lanreotide for Neuroendocrine Tumors". Medscape Medical News. WebMD LLC. Hentet 25. december 2014.
- ^ Everolimus og sunitib ved NET - Kræftens Bekæmpelse
- ^ Everolimus Approved for Pancreatic Neuroendocrine Tumors Arkiveret 16. juli 2016 hos Wayback Machine The ASCO Post. May 15, 2011, Volume 2, Issue 8
- ^ National Cancer Institute. Cancer Drug Information. FDA Approval for Sunitinib Malate Arkiveret 5. januar 2015 hos Wayback Machine. Pancreatic Neuroendocrine Tumors
- ^ Tejani MA, Saif MW (2014). "Pancreatic neuroendocrine tumors: Does chemotherapy work?". JOP: Journal of the pancreas. 15 (2): 132-4. doi:10.6092/1590-8577/2301 (inaktiv 2016-06-20). PMID 24618436.
{{cite journal}}: CS1-vedligeholdelse: DOI inaktiv siden juni 2016 (link) - ^ Text is available electronically (but may require free registration) See: Benson AB, Myerson RJ, Sasson AR. Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010. ISBN 978-0-615-41824-7. Arkiveret fra originalen 15. maj 2011. Hentet 7. januar 2017.
- ^ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C (2012). "Radionuclide therapy in neuroendocrine tumours: A systematic review". Clinical Oncology. 24 (4): 294-308. doi:10.1016/j.clon.2011.12.003. PMID 22221516.
- ^ Vinik AI (2014). "Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS)". Endocrine Practice. 20 (11): 1-23. doi:10.4158/EP14373.RA. PMID 25297671.
- ^ Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP (2010). "Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors". Seminars in Nuclear Medicine. 40 (2): 78-88. doi:10.1053/j.semnuclmed.2009.10.004. PMID 20113677.
- ^ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G (2014). "Peptide receptor radionuclide therapy for advanced neuroendocrine tumors". Thoracic Surgery Clinics. 24 (3): 333-49. doi:10.1016/j.thorsurg.2014.04.005. PMID 25065935.
- ^ Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E (2014). "Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors". Cancer Chemotherapy and Pharmacology. 75 (6): 1099-114. doi:10.1007/s00280-014-2642-2. PMID 25480314.
- ^ Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C (2014). "Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group". Annals of Surgical Oncology. 22 (8): 2685-99. doi:10.1245/s10434-014-4145-0. PMID 25366583.
- ^ "Palliative or Supportive Care". American Cancer Society. 2014. Arkiveret fra originalen 21. august 2014. Hentet 20. august 2014.
- ^ Buanes TA (14. august 2014). "Pancreatic cancer-improved care achievable". World Journal of Gastroenterology. 20 (30): 10405-18. doi:10.3748/wjg.v20.i30.10405. PMC 4130847. PMID 25132756.
- ^ "If treatment for pancreatic cancer stops working". American Cancer Society. 11. juni 2014. Arkiveret fra originalen 2014-10-22. Hentet 20. august 2014.
- ^ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA (2011). Arcidiacono PG (red.). "Celiac plexus block for pancreatic cancer pain in adults". Cochrane Database Syst Rev (3): CD007519. doi:10.1002/14651858.CD007519.pub2. PMID 21412903.
- ^ Eksokrin pancreasinsufficiens
- ^ Statistik om kræft i bugspytkirtlen - Kræftens Bekæmpelse
- ^ Thota R, Pauff JM, Berlin JD (januar 2014). "Treatment of metastatic pancreatic adenocarcinoma: a review". Oncology (Williston Park, N.Y.). 28 (1): 70-4. PMID 24683721.
- ^ Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, et al. (december 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095-128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- ^ a b Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR (1983). "History of the pancreas" (PDF). American Journal of Surgery. 146 (5): 539-50. doi:10.1016/0002-9610(83)90286-6. PMID 6356946.
- ^ a b c d Are C, Dhir M, Ravipati L (juni 2011). "History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers". HPB. 13 (6): 377-84. doi:10.1111/j.1477-2574.2011.00305.x. PMC 3103093. PMID 21609369.
- ^ a b Cameron JL, Riall TS, Coleman J, Belcher KA (juli 2006). "One thousand consecutive pancreaticoduodenectomies". Annals of Surgery. 244 (1): 10-5. doi:10.1097/01.sla.0000217673.04165.ea. PMC 1570590. PMID 16794383.
- ^ Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, Lillemoe KD, Warshaw AL (september 2012). "Evolution of the Whipple procedure at the Massachusetts General Hospital". Surgery. 152 (3 Suppl 1): S56-63. doi:10.1016/j.surg.2012.05.022. PMC 3806095. PMID 22770961.
- ^ Zyromski, Nicholas J.; Nakeeb, Attila; Lillemoe, Keith D. (2010). Silberman, Howard; Silberman, Allan W. (red.). Principles and practice of surgical oncology : multidisciplinary approach to difficult problems (online udgave). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. Chapter 35. ISBN 978-0-7817-6546-6. Arkiveret fra originalen den 6. februar 2015. Hentet 3. november 2014.
{{cite book}}: CS1-vedligeholdelse: BOT: original-url status ukendt (link) - ^ Wolpin BM, Stampfer MJ (juli 2009). "Defining determinants of pancreatic cancer risk: are we making progress?". J. Natl. Cancer Inst. 101 (14): 972-3. doi:10.1093/jnci/djp182. PMID 19561317.
- ^ "What's new in pancreatic cancer research and treatment?". American Cancer Society. 11. juni 2014. Arkiveret fra originalen 29. november 2016. Hentet 17. juli 2014.
- ^ "Pancreatic cancer research". Cancer Research UK. Arkiveret fra originalen 18. februar 2014. Hentet 17. juli 2014.
- ^ "Australian Pancreatic Genome Initiative". Garvan Institute. Hentet 17. juli 2014.
- ^ Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, Miller DK, Wilson PJ, et al. (november 2012). "Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes". Nature. 491 (7424): 399-405. Bibcode:2012Natur.491..399.. doi:10.1038/nature11547. PMC 3530898. PMID 23103869.
- ^ a b Pannala R, Basu A, Petersen GM, Chari ST (januar 2009). "New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer". Lancet Oncol. 10 (1): 88-95. doi:10.1016/S1470-2045(08)70337-1. PMC 2795483. PMID 19111249.
- ^ Graham JS, Jamieson NB, Rulach R, Grimmond SM, Chang DK, Biankin AV (november 2014). "Pancreatic cancer genomics: where can the science take us?". Clin. Genet. 88 (3): 213-9. doi:10.1111/cge.12536. PMID 25388820.
- ^ "About EUROPAC". European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. Hentet 17. juli 2014.
- ^ Zhang C, Yang G, Ling Y, Chen G, Zhou T (december 2014). "The early diagnosis of pancreatic cancer and diabetes: what's the relationship?". Journal of Gastrointestinal Oncology. 5 (6): 481-8. doi:10.3978/j.issn.2078-6891.2014.055 (inaktiv 2016-06-20). PMC 4226830. PMID 25436129.
{{cite journal}}: CS1-vedligeholdelse: DOI inaktiv siden juni 2016 (link) - ^ Bruenderman EH, Martin RC (13. oktober 2014). "High-risk population in sporadic pancreatic adenocarcinoma: guidelines for screening". The Journal of surgical research. 194 (1): 212-219. doi:10.1016/j.jss.2014.06.046. PMC 4559279. PMID 25479908.
- ^ Subar D, Gobardhan PD, Gayet B (2014). "Laparoscopic pancreatic surgery". Best Practice & Research Clinical Gastroenterology. 28 (1): 123-32. doi:10.1016/j.bpg.2013.11.011.
- ^ Weiss MJ, Wolfgang CL (2013). "Irreversible electroporation: a novel pancreatic cancer therapy". Current Problems in Cancer. 37 (5): 262-5. doi:10.1016/j.currproblcancer.2013.10.002. PMID 24331180.
- ^ Moir J, White SA, French JJ, Littler P, Manas DM (december 2014). "Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer". European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. 40 (12): 1598-1604. doi:10.1016/j.ejso.2014.08.480. PMID 25307210.
- ^ Al Haddad AH, Adrian TE (november 2014). "Challenges and future directions in therapeutics for pancreatic ductal adenocarcinoma". Expert Opin Investig Drugs. 23 (11): 1499-515. doi:10.1517/13543784.2014.933206. PMID 25078674.
- ^ Adiseshaiah, Pavan P.; Crist, Rachael M.; Hook, Sara S.; McNeil, Scott E. (2016). "Nanomedicine strategies to overcome the pathophysiological barriers of pancreatic cancer". Nature Reviews Clinical Oncology. 13: 750-765. doi:10.1038/nrclinonc.2016.119. ISSN 1759-4774.
- ^ Kleger A, Perkhofer L, Seufferlein T (juli 2014). "Smarter drugs emerging in pancreatic cancer therapy". Ann. Oncol. 25 (7): 1260-70. doi:10.1093/annonc/mdu013. PMID 24631947.
- ^ a b Tang SC, Chen YC (august 2014). "Novel therapeutic targets for pancreatic cancer". World Journal of Gastroenterology. 20 (31): 10825-44. doi:10.3748/wjg.v20.i31.10825. PMC 4138462. PMID 25152585.
- ^ a b Schober M, Jesenofsky R, Faissner R, Weidenauer C, Hagmann W, Michl P, Heuchel RL, Haas SL, Löhr JM (2014). "Desmoplasia and chemoresistance in pancreatic cancer". Cancers (Basel). 6 (4): 2137-54. doi:10.3390/cancers6042137. PMC 4276960. PMID 25337831.
- ^ Rossi ML, Rehman AA, Gondi CS (2014). "Therapeutic options for the management of pancreatic cancer". World J. Gastroenterol. 20 (32): 11142-59. doi:10.3748/wjg.v20.i32.11142. PMC 4145755. PMID 25170201.
- ^ Neesse A, Krug S, Gress TM, Tuveson DA, Michl P (2013). "Emerging concepts in pancreatic cancer medicine: targeting the tumor stroma". Onco Targets Ther. 7: 33-43. doi:10.2147/OTT.S38111. PMC 3872146. PMID 24379681.
- ^ Heinemann V, Reni M, Ychou M, Richel DJ, Macarulla T, Ducreux M (februar 2014). "Tumour-stroma interactions in pancreatic ductal adenocarcinoma: rationale and current evidence for new therapeutic strategies". Cancer Treat. Rev. 40 (1): 118-28. doi:10.1016/j.ctrv.2013.04.004. PMID 23849556.
- ^ Fong Y, Ady J, Heffner J, Klein E (2014). "Oncolytic viral therapy for pancreatic cancer: current research and future directions". Oncolytic Virotherapy: 35. doi:10.2147/OV.S53858.
- ^ Pavelic J (oktober 2014). "Editorial: combined cancer therapy". Curr. Pharm. Des. 20 (42): 6511-2. doi:10.2174/1381612820666140826154834. PMID 25341927.
Eksterne henvisninger
[redigér | rediger kildetekst]- Bugspytkirtelkræft, fra Kræftens Bekæmpelses hjemmeside.
- Kræft i bugspytkirtlen Arkiveret 24. maj 2011 hos Wayback Machine, gratis pjece om sygdommen, udgivet i 2011.
- Bugspytkirtelkræft på Curlie (som bygger videre på Open Directory Project)